Прогнозирование тяжести пневмонии COVID-19 на рентгеновском снимке
Необходимость рационализировать лечение пациентов с коронавирусной болезнью-19 (COVID-19) стала как никогда актуальной.
Рентген грудной клетки (CXR) является неинвазивным (возможно, прикроватным) инструментом для наблюдения за прогрессированием заболевания. В этом исследовании мы представляем модель прогнозирования степени тяжести пневмонии COVID-19 для фронтальных рентгеновских снимков грудной клетки. Такой инструмент может измерить тяжесть инфекций легких COVID-19 (и пневмонии в целом), что может быть использовано для эскалации или деэскалации помощи, а также для мониторинга эффективности лечения, особенно в отделениях интенсивной терапии.
Методы
Изображения из общедоступной базы данных COVID-19 были ретроспективно оценены тремя слепыми экспертами с точки зрения степени поражения легких, а также степени непрозрачности. Модель нейронной сети, которая была предварительно обучена на больших (не относящихся к COVID-19) наборах данных рентгеновских снимков грудной клетки, используется для создания функций для изображений COVID-19, которые являются прогностическими для нашей задачи.
Полученные результаты
Это исследование показывает, что обучение регрессионной модели на подмножестве результатов этой предварительно обученной модели рентгеновского снимка грудной клетки предсказывает нашу оценку географической протяженности (диапазон 0-8) со средней абсолютной ошибкой 1,14 (средняя абсолютная ошибка) (MAE) и нашей оценкой непрозрачности легких (диапазон 0-6) с 0,78 MAE.
Выводы
Эти результаты показывают, что способность нашей модели измерять тяжесть инфекций легких COVID-19 может быть использована для эскалации или деэскалации помощи, а также для мониторинга эффективности лечения, особенно в отделениях интенсивной терапии. Чтобы обеспечить дальнейшую работу, мы делаем наш код, ярлыки и данные доступными в Интернете.
Введение
Поскольку первые страны изучают стратегии деконфайнмента [1] , число погибших от коронавирусной болезни-19 (COVID-19) продолжает расти [2] . Повышенная нагрузка, вызванная пандемией на системы здравоохранения во всем мире, побудила многих врачей прибегнуть к новым стратегиям и технологиям. Рентген грудной клетки (CXR) представляет собой неинвазивный (потенциально прикроватный) инструмент для наблюдения за прогрессированием заболевания [3,4] . Еще в марте 2020 года китайские больницы использовали компьютерную томографию (КТ) с помощью искусственного интеллекта (ИИ) для выявления случаев COVID-19 и оптимизации диагностики [5]. С тех пор многие команды приступили к реализации инициатив по ИИ для улучшения сортировки пациентов с COVID-19 (например, выписка, общая госпитализация или лечение в отделении интенсивной терапии) и распределения больничных ресурсов (например, от прямой неинвазивной вентиляции к инвазивной) [6] . В то время как эти последние инструменты используют клинические данные, практически развертываемые прогностические модели на основе CXR по-прежнему отсутствуют.
В этой работе мы построили и изучили модель, которая прогнозирует тяжесть пневмонии COVID-19 на основе рентгеновских снимков, которая будет использоваться в качестве вспомогательного инструмента при оказании помощи пациентам. Возможность измерить тяжесть инфекций легких COVID-19 может использоваться для эскалации или деэскалации помощи, особенно в отделениях интенсивной терапии. Автоматизированный инструмент может применяться к пациентам с течением времени, чтобы объективно и количественно отслеживать прогрессирование заболевания и реакцию на лечение.
Материалы и методы
2.1 Когорта COVID-19
Мы использовали ретроспективную когорту из 94 задне-передних (ПА) изображений рентгенографии из общедоступной коллекции данных изображений COVID-19 [7] . Хотя в настоящее время набор данных содержит 153 изображения, на момент эксперимента он насчитывал только 94 изображения, и все они были включены в исследование. Все пациенты были зарегистрированы их врачами как положительные на COVID-19 (большинство из них использовали ОТ-ПЦР) и получены из многих больниц по всему миру с декабря 2019 года по март 2020 года. Изображения были деидентифицированы до нашего использования, и отсутствующие данные отсутствовали. . Соотношение мужчин и женщин составляло 44/36, средний возраст 56 ± 14,8 (55 ± 15,6 для мужчин и 57 ± 13,9 для женщин).
2.2 Этикетки
Радиологическая оценка проводилась тремя слепыми экспертами: двумя рентгенологами грудной клетки (каждый с опытом работы не менее 20 лет) и ординатором-радиологом. Они определили степень тяжести заболевания с помощью балльной системы [8] , основанной на двух типах баллов (параметров): степени поражения легких и степени помутнения. Им одновременно предоставляли только одно рентгеновское изображение без какого-либо клинического контекста пациента.
1. Степень поражения легких из-за непрозрачности или уплотнения матового стекла для каждого легкого (правое легкое и левое легкое отдельно) оценивалась как: 0 = отсутствие поражения; 1 = участие <25%; 2 = вовлеченность 25% -50%; 3 = вовлеченность 50% -75%; 4 => 75% вовлеченности. Общая оценка степени варьировала от 0 до 8 (правое легкое и левое легкое вместе).
2. Степень непрозрачности для каждого легкого (правое легкое и левое легкое отдельно) оценивали как: 0 = отсутствие помутнения; 1 = матовое стекло непрозрачность; 2 = уплотнение; 3 = белый цвет. Общая оценка непрозрачности варьировалась от 0 до 6 (правое легкое и левое легкое вместе).
Электронная таблица была сохранена для пары имен файлов с их соответствующими оценками. Каппа Флейса для межэкспертного согласия составила 0,45 для оценки непрозрачности и 0,71 для оценки степени.
2.3 Наборы данных, не относящихся к COVID-19 (до обучения)
Перед экспериментом модель была обучена на следующих общедоступных наборах данных, ни один из которых не содержал случаев COVID-19:
– Радиологическое общество Северной Америки (RSNA) Проблема обнаружения пневмонии [9] ;
– набор данных CheXpert из Стэнфордского университета [10] ;
– Набор данных ChestX-ray8 от Национального института здравоохранения (NIH) [11] ;
– набор данных ChestX-ray8 от NIH с метками от Google [12] ;
– набор данных MIMIC-CXR от Массачусетского технологического института (MIT) [13] ;
– Набор данных PadChest из Университета Аликанте [14] ;
– OpenI [15]
Эти семь наборов данных были вручную согласованы друг с другом для выполнения 18 общих задач радиологического поиска, чтобы обучить модель с использованием всех наборов данных одновременно (ателектаз, консолидация, инфильтрация, пневмоторакс, отек, эмфизема, фиброз, фиброз, выпот, пневмония, утолщение плевры, кардиомегалия, узелок, образование, грыжа, поражение легких, перелом, помутнение легких и увеличение кардиомедиастинума). Например, «плевральный выпот» из одного набора данных считается таким же, как «выпот» из другого набора данных, чтобы эти метки считались равными. В общей сложности для обучения модели этим задачам было использовано 88079 изображений, не относящихся к COVID-19.
2.4 Модель, предварительная обработка и предварительное обучение
В этом исследовании мы использовали модель DenseNet [16] из библиотеки TorchXRayVision [ 17,18 ] . Было показано, что модели DenseNet хорошо предсказывают пневмонию [19] . Размер изображений был изменен до 224×224 пикселей с использованием кадрирования по центру, если соотношение сторон было неравномерным, а значения пикселей были масштабированы до (-1024, 1024) для обучения.
Перед обработкой изображений COVID-19 был выполнен этап предварительного обучения с использованием семи наборов данных для обучения слоев извлечения признаков и слоя прогнозирования задач (рисунок 1 ). Этот этап «предварительной подготовки» был выполнен на большом наборе данных, чтобы построить общие представления о легких и других аспектах рентгенографии, которых мы не смогли бы достичь на небольшом наборе доступных изображений COVID-19. Ожидается, что некоторые из этих представлений будут иметь отношение к нашим последующим задачам. Есть несколько способов извлечь полезные функции из предварительно обученной модели, как показано на рисунке 1 .

Рисунок 1: Схема функций, извлеченных из изображений
Два блока набора данных показывают, что изображения COVID-19 не использовались для обучения нейронной сети. Схема сети разделена на три части. Слои выделения признаков представляют собой сверточные слои, которые преобразуют изображение в 1024-мерный вектор, который называется промежуточными сетевыми объектами. Затем эти функции преобразуются с использованием уровня прогнозирования задачи (сигмоидальная функция для каждой задачи) в выходные данные для каждой задачи. Показаны различные группы результатов, использованные в этой работе.
2.5 Обучение
Подобно изображениям из наборов данных, не относящихся к COVID-19, которые использовались для предварительного обучения, каждое изображение из набора данных COVID-19 было предварительно обработано (размер изменено, обрезано по центру, масштабировано), а затем обработано слоями извлечения признаков и слоем прогнозирования задач сеть. Сеть была обучена на существующих наборах данных до того, как веса были заморожены. Изображения COVID-19 были обработаны сетью для создания функций, используемых вместо изображений. Как и в случае с изображениями из семи наборов данных, не относящихся к COVID-19, слои извлечения признаков создали представление 94 изображений COVID-19 с использованием 1024-мерного вектора, а затем полностью связанный слой прогнозирования задач выдал выходные данные для каждого из 18 оригинальные задания. Мы строим модели на предварительных сигмовидных выходах.
Линейная регрессия была проведена для прогнозирования вышеупомянутых баллов (степени поражения легких и непрозрачности) с использованием этих различных наборов функций вместо самого изображения:
– Промежуточные сетевые функции – результат применения сверточных слоев к изображению, в результате чего получается 1024-мерный вектор, который передается на уровень прогнозирования задачи;
– 18 выходов – каждое изображение было представлено 18 выходами (pre-sigmoid) из предварительно обученной модели;
– Четыре выхода – использовалась вручную подобранная подгруппа выходов (предварительная сигмовидная), содержащая рентгенологические данные, более частые при пневмонии (помутнение легких, пневмония, инфильтрация и уплотнение);
– Выходной сигнал непрозрачности легкого – использовался единственный выход (предварительная сигмовидная) для непрозрачности легкого, поскольку он был очень связан с этой задачей. Эта функция отличалась от показателя непрозрачности, который мы хотели спрогнозировать.
Для каждого проведенного эксперимента набор данных из 94 изображений COVID-19 был случайным образом разделен на поезд и тестовый набор примерно 50/50. Несколько временных точек от одного и того же пациента были сгруппированы в одно и то же разделение, чтобы пациент не охватил оба набора. Выборка повторялась на протяжении всего обучения, чтобы получить среднее значение и стандартное отклонение для каждого выступления. Поскольку использовалась линейная регрессия, не нужно было преждевременно останавливаться, чтобы предотвратить переобучение модели. Следовательно, критерием определения окончательной модели была только среднеквадратичная ошибка (MSE) на обучающей выборке.
2.6 Карты значимости
Чтобы гарантировать, что модели учитывают разумные аспекты изображений [20-22] , карта значимости вычисляется путем вычисления градиента выходного предсказания по отношению к входному изображению (если пиксель изменяется, насколько это меняет прогноз). Чтобы сгладить карту значимости, она размывается с использованием гауссова ядра 5×5. Имейте в виду, что эти карты значимости имеют ограничения и предлагают лишь ограниченное представление о том, почему модель сделала прогноз [22,23] .
Полученные результаты
3.1 Количественные показатели эффективности
Единичный выходной сигнал «помутнение легкого» как признак дал наилучшую корреляцию (0,80), за ним следовали четыре выходных параметра (помутнение легких, пневмония, инфильтрация и консолидация) (0,79) (Таблица 1). Построение модели только на нескольких выходных данных обеспечивает наилучшую производительность. Средняя абсолютная ошибка (MAE) полезна для понимания ошибки в единицах оценок, которые прогнозируются, в то время как MSE помогает ранжировать различные методы на основе их самых дальних выбросов. Одна из возможных причин того, что меньшее количество функций работает лучше всего, состоит в том, что меньшее количество параметров предотвращает переобучение. Некоторые функции могут служить прокси-переменными для искажающих атрибутов, таких как пол или возраст, и предотвращение использования этих функций предотвращает снижение отвлечения внимания на производительность обобщения. Выбор вручную подмножеств функций, которые интуитивно связаны с этой задачей, привносит знания в предметную область как предвзятость модели, что повышает производительность. Таким образом, наиболее эффективная модель (с использованием единственного вывода «непрозрачность легких» в качестве характеристики) используется для последующего качественного анализа.
| Задача | Использование функций: | # параметров (чем меньше, тем лучше) | Корреляции Пирсона | R 2 | MAE | MSE |
| Оценка непрозрачности | вывод “помутнение легких” | 1 + 1 | 0,78 ± 0,04 | 0,58 ± 0,09 | 0,78 ± 0,05 | 0,86 ± 0,11 |
| 4 выхода | 4 + 1 | 0,78 ± 0,04 | 0,58 ± 0,09 | 0,76 ± 0,05 | 0,87 ± 0,12 | |
| 18 выходов | 18 + 1 | 0,73 ± 0,09 | 0,44 ± 0,16 | 0,86 ± 0,11 | 1,15 ± 0,33 | |
| Промежуточные сетевые функции | 1024 + 1 | 0,66 ± 0,08 | 0,25 ± 0,21 | 1,01 ± 0,09 | 1,54 ± 0,28 | |
| Нет данных | 0 + 1 | -0,00 ± 0,00 | -0,08 ± 0,10 | 1,24 ± 0,10 | 2,26 ± 0,36 | |
| Географический охват | вывод “помутнение легких” | 1 + 1 | 0,80 ± 0,05 | 0,60 ± 0,09 | 1,14 ± 0,11 | 2,06 ± 0,34 |
| 4 выхода | 4 + 1 | 0,79 ± 0,05 | 0,57 ± 0,10 | 1,19 ± 0,11 | 2,17 ± 0,37 | |
| 18 выходов | 18 + 1 | 0,76 ± 0,08 | 0,47 ± 0,16 | 1,32 ± 0,17 | 2,73 ± 0,89 | |
| Промежуточные сетевые функции | 1024 + 1 | 0,74 ± 0,08 | 0,43 ± 0,16 | 1,36 ± 0,13 | 2,88 ± 0,58 | |
| Нет данных | 0 + 1 | 0,00 ± 0,00 | -0,08 ± 0,10 | 2,00 ± 0,17 | 5,60 ± 0,95 |
Таблица 1: Показатели производительности каждого набора функций для прогноза непрозрачности и географического охвата
Оценка выполняется на 50 случайно выбранных тестовых разделах поездов, а показатели здесь вычисляются на удерживаемом наборе тестов.
R2: коэффициент детерминации; MAE: средняя абсолютная ошибка; MSE: среднеквадратическая ошибка. «Четыре выхода» относятся к помутнению легких, пневмонии, инфильтрации и консолидации.
3.2 Качественный анализ прогнозируемых баллов
На рисунке 2 показаны прогнозы наиболее эффективной модели (с использованием единственного выходного сигнала «непрозрачность легких» в качестве характеристики) в сравнении с оценкой достоверности данных (полученной ослепленными экспертами) на имеющихся данных испытаний. Большинство точек данных находится близко к линии единицы. Модель переоценивает баллы от 1 до 3 и занижает баллы выше 4. Однако в целом прогнозы кажутся разумными с учетом согласия экспертов.
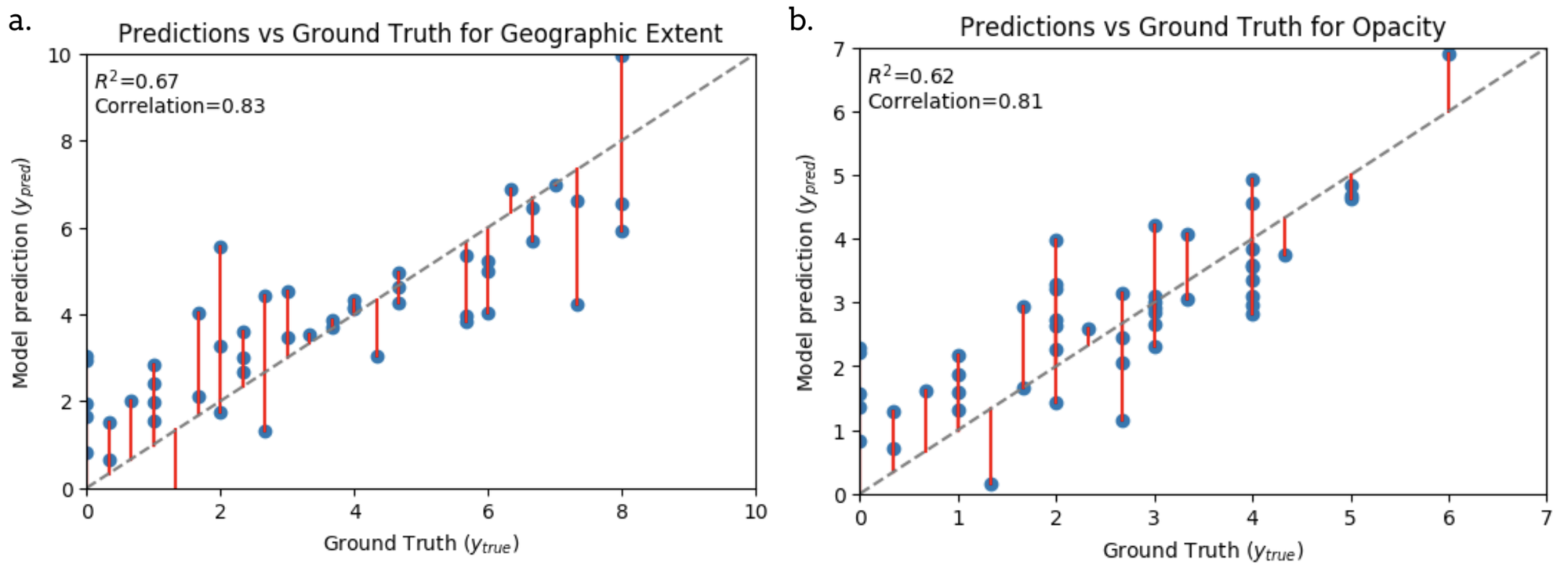
Рисунок 2: Диаграммы разброса, показывающие соответствие между нашими лучшими прогнозами модели и человеческими аннотациями (достоверные данные) для оценок географической протяженности и непрозрачности
Оценка проводится на длительном тестовом наборе. Серая пунктирная линия – идеальный прогноз. Красные линии указывают на ошибку точного прогноза.
R 2 : коэффициент детерминации.
3.3 Изучение заученных представлений
На рисунке 3 мы исследуем то, на что смотрит представление, используемое одной из лучших моделей, чтобы выявить признаки переобучения и получить представление об изменении данных. T-распределенное стохастическое вложение соседей (t-SNE) [24] вычисляется для всех данных (даже тех, которые не оцениваются), чтобы спроецировать признаки в двумерное (2D) пространство. Каждый CXR представлен точкой в пространстве, где отношения с другими точками сохраняются из пространства более высоких измерений. Случаи группы выживания, как правило, группируются вместе, как и случаи группы умерших. Эта кластеризация указывает на то, что прогнозы оценки соответствуют клиническим исходам.
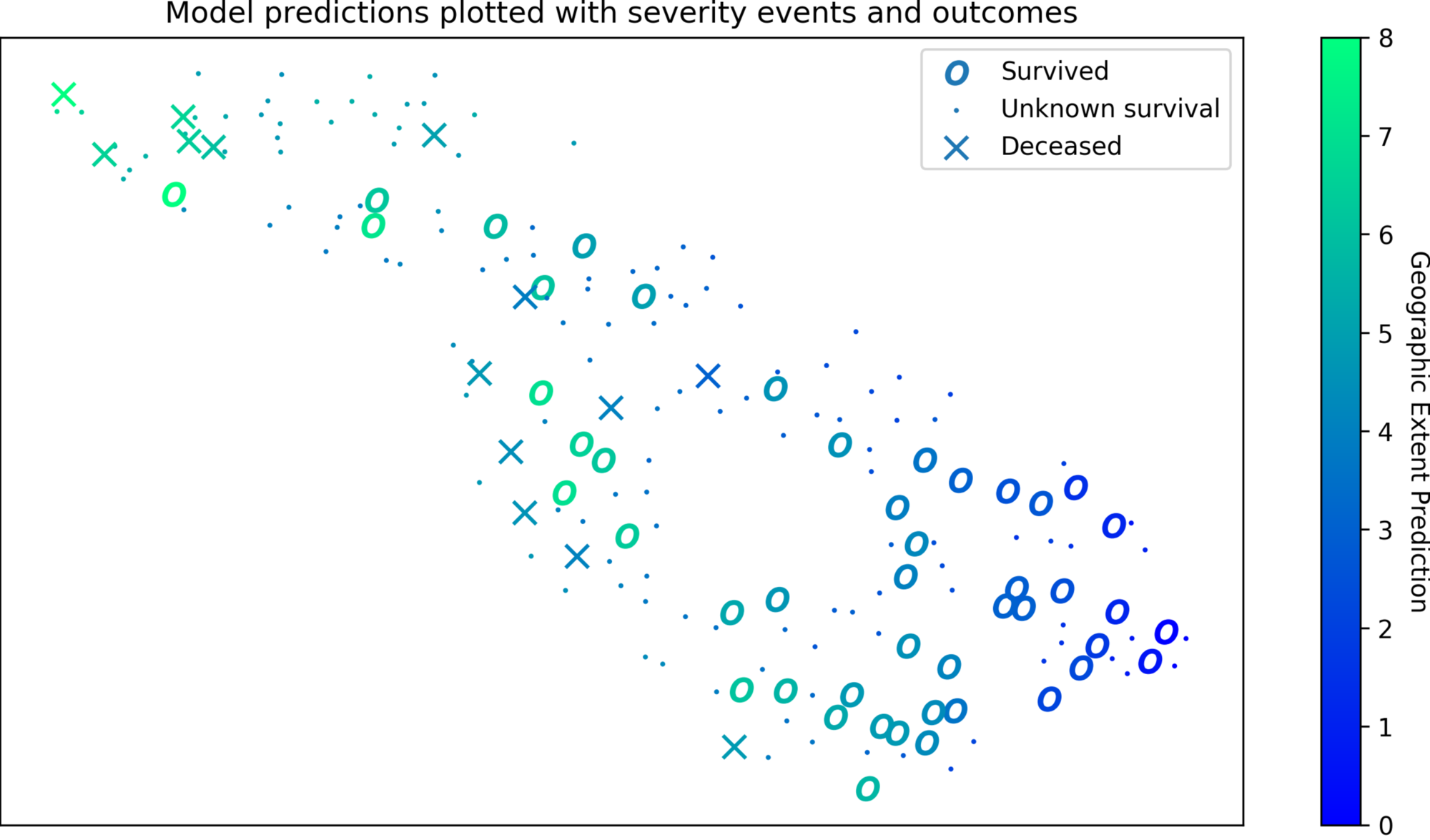 Рисунок 3: Визуализация представлений характеристик с прогнозированием географической протяженности и результатами выживания
Рисунок 3: Визуализация представлений характеристик с прогнозированием географической протяженности и результатами выживания
Пространственное представление специфических особенностей пневмонии (помутнение легких, пневмония, инфильтрация и консолидация) при проецировании в 2 измерения (2D) с использованием t-распределенного стохастического встраивания соседей (t-SNE). В этом двухмерном пространстве сохраняются многомерные (4D) расстояния, в частности, что находится поблизости. Изображения CXR, которые имеют похожие выходные данные, близки друг к другу. Характеристики извлекаются для всех 208 изображений в наборе данных, и для каждого изображения отображается прогноз географического экстента. Информация о выживании, доступная в наборе данных, представлена формой маркера.
3.4 Проверка карт яркости
На рисунке 4 изучаются изображения, которые модель не видела во время обучения. Для большинства результатов модель правильно рассматривает непрозрачные области легких. На рисунке 4b нет признаков непрозрачности, а модель сфокусирована на сердце и диафрагме, что, вероятно, является признаком того, что они используются в качестве эталона цвета при определении того, что считается непрозрачным. На рисунках 4c и 4d мы видим ошибочные прогнозы.

Рисунок 4: Карты значимости прогнозов модели
Примеры правильных (a, b) и неправильных (c, d) предсказаний модели показаны с картой значимости, созданной путем вычисления градиента выходного предсказания по отношению к входному изображению, а затем размытой с использованием гауссова ядра 5×5. Назначенные и прогнозируемые баллы для географического охвата показаны справа.
Обсуждение
В контексте пандемии и безотлагательности сдерживания кризиса объем исследований резко увеличился, чтобы облегчить бремя системы здравоохранения. Тем не менее, многие модели прогнозирования для диагностики и прогноза инфекции COVID-19 подвержены высокому риску систематической ошибки и переобучения модели, а также плохо описаны, а их предполагаемая эффективность, вероятно, оптимистична [25] . Чтобы предотвратить преждевременное внедрение в больницах [26] , инструменты должны быть тщательно проверены по нескольким практическим направлениям [18,27] . В самом деле, хотя некоторые инструменты с использованием искусственного интеллекта могут быть мощными, они не заменяют клинических суждений, и их диагностическая эффективность не может быть оценена или заявлена без надлежащего клинического исследования [28] .
Существующая работа сосредоточена на прогнозировании степени тяжести на основании различных клинических показателей, включая результаты визуализации грудной клетки [29] . Такие модели, как представленная в этой работе, могут дополнять и улучшать решения о сортировке с помощью рентгенографии по сравнению с КТ [30] .
Сложности при создании прогнозной модели включают маркировку данных и достижение хорошего согласия между экспертами, а также изучение представления, которое будет обобщаться на новые изображения, когда количество помеченных изображений настолько мало. В случае создания инструмента прогнозирования для изображений CXR COVID-19 отсутствие общедоступной базы данных затруднило проведение крупномасштабных надежных оценок. Такое небольшое количество образцов препятствует правильному отбору когорты, что является ограничением этого исследования и подвергает нашу оценку систематической ошибке выборки. Однако мы используем модель, которая была обучена на большом наборе данных со связанными задачами, которая предоставила нам надежный объективный экстрактор функций COVID-19 и позволяет нам узнать только два параметра для нашей лучшей модели линейной регрессии. Такое ограничение сложности усвоенной модели снижает вероятность переобучения.
Нашу оценку можно было бы улучшить, если бы мы смогли получить новые когорты, помеченные с той же степенью серьезности, чтобы убедиться в обобщении нашей модели. Кроме того, неизвестно, отражают ли эти рентгенологические оценки тяжести заболевания фактические функциональные или клинические результаты, поскольку в открытых данных таких данных нет. Мы публикуем изображения, ярлыки, модель и код из этой работы, чтобы другие группы могли выполнять последующие оценки.
Выводы
Способность нашей модели измерять тяжесть инфекций легких COVID-19 может быть использована для эскалации или деэскалации помощи, а также для мониторинга эффективности лечения, особенно в отделениях интенсивной терапии. Использование шкалы, сочетающей географическую протяженность и степень непрозрачности, позволяет врачам сравнивать изображения CXR друг с другом, используя количественные и объективные критерии. Кроме того, это можно сделать в масштабе для крупномасштабного анализа.
Ссылки
- Детям в Испании разрешено играть на открытом воздухе, поскольку страна облегчает изоляцию от COVID-19 . (2020). Дата обращения: 10 июня 2020 г .: https://globalnews.ca/news/6869737/ coronavirus-spain-children-outdoor-play / .
- В США зарегистрировано более 2000 смертей от коронавируса за один день, общее число погибших достигает 100000 . (2020). Дата обращения: 10 июня 2020 г .: https://www.washingtonpost.com/world/2020/04/09/coronavirus-latest-news/ .
- Юн С.Х., Ли К.Х., Ким Дж.Й. и др.: Результаты рентгенографии грудной клетки и компьютерной томографии нового коронавирусного заболевания 2019 года (COVID-19): анализ девяти пациентов, пролеченных в Корее . Корейский J Radiol. 2020, 21: 494-500. 10.3348 / kjr.2020.0132
- Ng MY, Lee EYP, Yang J и др.: Профиль визуализации инфекции COVID-19: радиологические данные и обзор литературы . Радиология. 2020, 2: 1. 10.1148 / ryct.2020200034
- Jin YH, Cai L, Cheng ZS и др.: Краткое руководство по диагностике и лечению пневмонии, инфицированной новым коронавирусом 2019 (2019-nCoV) (стандартная версия). Военно-медицинские исследования. 2020, 10.1186 / s40779-020-0233-6
- AI может помочь больницам в сортировке пациентов с COVID-19 . (2020). Доступ: 10 июня 2020 г.: https://spectrum.ieee.org/the-human-os/artificial-intelligence/medical-ai/ai-can-help-hospitals-triage-covid19-patients .
- Сбор данных изображений COVID-19 . (2020). Дата обращения: 10 июня 2020 г .: https://arxiv.org/abs/2003.11597 .
- Wong HYF, Lam HYS, Fong AHT и др .: Частота и распределение рентгенологических результатов грудной клетки у пациентов с положительным результатом на COVID-19 . Радиология. 2020, 296: E72-E78. 10.1148 / радиол.2020201160
- Ши Г., Ву К., Халаби С. и др.: Дополнение данных рентгенограмм грудной клетки Национальным институтом здравоохранения экспертными аннотациями о возможной пневмонии . Радиология. 2020, 1: 1. 10.1148 / ryai.2019180041
- Chexpert: большой набор данных рентгенограммы грудной клетки с метками неопределенности и экспертным сравнением . (2019). Дата обращения: 10 июня 2020 г .: https://arxiv.org/abs/1901.07031 .
- Рентген грудной клетки: база данных рентгеновских снимков грудной клетки в масштабе больницы и контрольные показатели по классификации и локализации распространенных заболеваний грудной клетки при слабом контроле . (2017). Дата обращения: 10 июня 2020 г .: https://arxiv.org/%20abs/1705.02315 .
- Майковска А., Миттал С., Штайнер Д.Ф. и др.: Интерпретация рентгенограммы грудной клетки с моделями глубокого обучения: оценка с использованием эталонных стандартов, утвержденных радиологами, и оценка с поправкой на популяцию . Радиология. 2019, 294: 421-431. 10.1148 / радиол.2019191293
- Johnson AEW, Pollard TJ, Berkowitz SJ и др.: MIMIC-CXR, деидентифицированная общедоступная база данных рентгенограмм грудной клетки с отчетами в свободном тексте . Научные данные. 2019, 6: 317. 10.1038 / s41597-019-0322-0
- PadChest: большой набор данных рентгеновского снимка грудной клетки с аннотированными отчетами с несколькими метками . (2019). Дата обращения: 10 июня 2020 г .: https://arxiv.org/abs/1901.07441 .
- Демнер-Фушман Д., Кохли М.Д., Розенман М.Б. и др .: Подготовка коллекции радиологических исследований для распространения и извлечения . J Am Med Inform Assoc. 2016, 23: 304-310. 10.1093 / Jamia / ocv080
- Плотно связанные сверточные сети . (2017). Дата обращения: 10 июня 2020 г .: https://arxiv.org/abs/1608.06993 .
- TorchXRayVision: библиотека наборов данных и моделей рентгеновских снимков грудной клетки . (2020). Дата обращения: 10 июня 2020 г .: https://github.com/mlmed/torchxrayvision .
- О пределах междоменного обобщения в автоматизированном прогнозировании рентгеновских лучей . (2020). Дата обращения: 10 июня 2020 г .: https://arxiv.org/abs/2002.02497 .
- CheXNet: обнаружение пневмонии на уровне радиолога на рентгенограммах грудной клетки с глубоким обучением . (2017). Дата обращения: 10 июня 2020 г .: https://arxiv.org/abs/1711.05225 .
- Reed RD, Marks RJ: Neural Smithing: контролируемое обучение в искусственных нейронных сетях с прямой связью . Книга Брэдфорда, Кембридж, Массачусетс; 1999 г.
- Zech JR, Badgeley MA, Liu M, Costa AB, Titano JJ, Oermann EK: переменная обобщенная производительность модели глубокого обучения для обнаружения пневмонии на рентгенограммах грудной клетки: поперечное исследование . PLoS Med. 2018, 15: e1002683. 10.1371 / journal.pmed.1002683
- Неудовлетворительные улучшения обобщения от контроля атрибуции признаков . (2019). Дата обращения: 10 июня 2020 г .: https://arxiv.org/abs/1910.00199 .
- Правильно по правильным причинам: обучение дифференцируемых моделей путем ограничения их объяснений . (2017). Дата обращения: 10 июня 2020 г .: https://arxiv.org/abs/1703.03717 .
- ван дер Маатен Л., Хинтон Г.: Визуализация данных с использованием t-SNE . J Mach Learn Res. 2008, 9: 2579-2605.
- Wynants L, Van Calster B, Collins GS и др.: Модели прогнозирования для диагностики и прогноза инфекции covid-19: систематический обзор и критическая оценка . BMJ. 2020, 368: m1328. 10.1136 / bmj.m1328
- Больницы используют искусственный интеллект, чтобы предсказать снижение числа пациентов с Covid-19, даже не зная, что это работает . (2020). Дата обращения: 10 июня 2020 г .: https://www.statnews.com/2020/04/24/coronavirus-hospitals-use-ai-to-predict-patient-decline-before-knowing-it-works/ .
- Ghassemi M, Naumann T, Schulam P, Beam AL, Chen I.Y, Ranganath R: Практическое руководство по искусственному интеллекту для данных здравоохранения . Ланцет. 2019, 1: e157-e159. 10.1016 / S2589-7500 (19) 30084-6
- Nagendran M, Chen Y, Lovejoy CA и др.: Искусственный интеллект против клиницистов: систематический обзор дизайна, стандартов отчетности и требований исследований глубокого обучения . BMJ. 2020, 368: m689. 10.1136 / bmj.m689
- Тусси Д., Вутсинас Н., Финкельштейн М. и др.: Клинические и рентгенографические характеристики определяют исходы для пациентов молодого и среднего возраста с COVID-19 . Радиология. 2020, 10.1148 / радиол.2020201754
- Рубин Г.Д., Райерсон С.Дж., Харамати Л.Б. и др.: Роль визуализации грудной клетки в ведении пациентов во время пандемии COVID-19: международное консенсусное заявление общества Флейшнера . Радиология. 2020, 296: 172-180. 10.1148 / радиол.2020201365
Автор: Cohen J, Dao L, Roth K, et al. (28 июля 2020 г.) Прогнозирование тяжести пневмонии COVID-19 на рентгеновском снимке грудной клетки с помощью глубокого обучения. Cureus 12 (7): e9448. DOI: 10.7759 / cureus.9448
Источник: www.cureus.com

 COVID-19
COVID-19