Кожно-кишечные свищи: учебник для рентгенологов с упором на КТ и МРТ
Абстрактный
Кожно-кишечные свищи (ECFs) представляют собой патологические сообщения между желудочно-кишечным трактом и кожей. В настоящее время большинство (~80%) ЭЦЖ развиваются вторично после абдоминальных операций; альтернативные, менее распространенные причины включают хронические воспалительные заболевания кишечника (ВЗК), такие как болезнь Крона, опухоли и радиационный энтерит, в порядке убывания частоты. Эти редкие расстройства требуют тщательной оценки состояния пациента и междисциплинарного лечения, чтобы ограничить связанную с ним заболеваемость и смертность. Этот наглядный обзор включает в себя обзор причин, клинических проявлений, осложнений и лечения ECF. После этого визуализационные проявления, дифференциальные диагнозы и терапевтические возможности послеоперационных, связанных с ВЗК и злокачественных ECF представлены с примерами случаев. Основное внимание уделяется текущей ключевой роли КТ и МРТ, которые всесторонне отображают ECF, предоставляя перекрестную информацию о лежащих в основе послеоперационных, неопластических, инфекционных или воспалительных состояниях. Рентгенографическая фистулография остается действенным методом, который быстро отображает анатомию ECF и подтверждает связь с кишечником. Цель этой статьи — ознакомить рентгенологов с визуализацией ECF, что позволит сделать правильный выбор между медикаментозным, интервенционным или хирургическим лечением, что в конечном итоге приведет к более высокой вероятности терапевтического успеха. который быстро изображает анатомию ECF и подтверждает связь с кишечником. Цель этой статьи — ознакомить рентгенологов с визуализацией ECF, что позволит сделать правильный выбор между медикаментозным, интервенционным или хирургическим лечением, что в конечном итоге приведет к более высокой вероятности терапевтического успеха. который быстро изображает анатомию ECF и подтверждает связь с кишечником. Цель этой статьи — ознакомить рентгенологов с визуализацией ECF, что позволит сделать правильный выбор между медикаментозным, интервенционным или хирургическим лечением, что в конечном итоге приведет к более высокой вероятности терапевтического успеха.
Основные тезисы
• Кожно-кишечные свищи могут осложнить абдоминальную хирургию, иногда болезнь Крона и опухоли .
• Высокий уровень заболеваемости и смертности в результате сепсиса, недостаточности питания и метаболического дисбаланса .
• Междисциплинарное ведение внеклеточных муковисцидоза требует тщательной визуализации для правильного выбора терапии .
• Рентгенографическая фистулография быстро отображает свищи и сообщающиеся петли кишечника в режиме реального времени .
• Мультидетекторная КТ и МРТ предоставляют перекрестную информацию о свищах и основных заболеваниях .
Введение
Кожно-кишечные свищи (ECFs) определяются как аномальные связи между желудочно-кишечным трактом (GI) и кожей. Несмотря на то, что они относительно редки по сравнению с прошлыми десятилетиями, ECF по-прежнему представляют собой одно из самых сложных состояний, встречающихся в хирургической практике, отягощенное тяжелой заболеваемостью, ухудшением качества жизни и значительной смертностью [ 1 , 2 , 3 ].
В последние годы специализированные центры разработали надежный подход к лечению, который сочетает в себе опыт хирургов, интервенционных радиологов, врачей интенсивной терапии, диетологов, специалистов по уходу за ранами и медсестер. Как показано в таблице 1 , это междисциплинарное лечение основано на тщательной диагностической визуализации для правильного отбора пациентов и выбора терапии: к сожалению, существует очень мало литературы по поперечной визуализации ECF [ 4 , 5 ].
Этот наглядный обзор основан на опыте специализированной больницы третичного уровня, где проводятся операции по поводу онкологических заболеваний и хронических воспалительных заболеваний кишечника (ВЗК). Он включает в себя обзор причин, клинических проявлений, осложнений и тактики лечения ЭКФ. После этого с примерами представлены изображения, дифференциальная диагностика и терапевтические возможности послеоперационных, хронических воспалительных заболеваний кишечника (ВЗК) и злокачественных ECF. Основное внимание уделяется текущей ключевой роли КТ и МРТ, которые всесторонне отображают ECF, предоставляя перекрестную информацию о лежащих в основе послеоперационных, неопластических, инфекционных или воспалительных заболеваниях.
Наша цель состоит в том, чтобы расширить знакомство радиологов с визуализацией ECF, что позволит сделать правильный выбор между медикаментозным, интервенционным или хирургическим лечением, что в конечном итоге приведет к более высокой вероятности терапевтического успеха.
Клинический обзор кишечно-кожных свищей
Происхождение ECF может лежать в любом месте желудочно-кишечного тракта и обнаруживается в тонкой кишке, толстой кишке, желудке и двенадцатиперстной кишке в порядке убывания частоты. В настоящее время большинство (75–85%) ЭЦФ развиваются в послеоперационном периоде после онкологических абдоминальных операций, резекций кишечника по поводу болезни Крона (БК), вентральной герниопластики и повторных лапаротомий. Остальные, спонтанные ECF возникают вторично по отношению к ВЗК (в основном БК, а не к неопределенным и язвенным колитам), свищевым опухолям, лучевому энтериту, дивертикулиту толстой кишки, внутрибрюшному сепсису и травме, в порядке убывания частоты [ 1 , 2 , 3 , 6 ]. ].
Отличительной клинической находкой является наружное свищевое отверстие (НФО) на передней или боковой брюшной стенке, которое часто окружено воспаленным, болезненным кожным участком, а иногда может быть скрыто под кожной складкой или находится в месте недавнего свища. или еще открытый хирургический разрез. Выделения могут быть как периодическими, так и непрерывными, иногда гнойными или каловыми. Выход внеклеточной жидкости может быть определен количественно и классифицирован как низкий (ниже 200 мл/день), умеренный или высокий (более 500 мл/день). Макроскопические и биохимические характеристики выделений дают полезные сведения о происхождении ECF [ 1 , 2 , 3 , 6 ].
Исторически смертность, связанная с ECF, превышала 50%, особенно у пациентов с высокопродуктивными фистулами, опухолями и сепсисом. За последние 15 лет усовершенствования в хирургии, уходе за ранами, нутритивной и метаболической поддержке привели к снижению смертности (8–13%) и конечному терапевтическому успеху в среднем через 6 недель у 75–91% пациентов [ 1 , 2 , 3 , 6 ].
Тем не менее, показатели консервативного заживления остаются низкими (~ 20–27% случаев в целом), а ECF по-прежнему представляют собой хронические изнурительные состояния, связанные с длительным пребыванием в отделении интенсивной терапии и больнице. Заболеваемость, связанная с ECF, возникает из-за сепсиса, недостаточности питания и метаболического дисбаланса. Неизменные водно-электролитные нарушения являются результатом комбинированного эффекта затяжного катаболического лихорадочного состояния, кишечной непроходимости или непроходимости, нарушения целостности кишечника и всасывания. Дальнейшие осложнения включают генерализованный перитонит, абсцессы брюшной стенки и некротизирующий фасциит, вторичный по отношению к повреждению мягких тканей бактериями и пищеварительными соками [ 7 , 8 ].
Этиология ECF является единственным лучшим прогностическим фактором и предиктором терапевтического успеха [ 9 ]. На самом деле, причина и лежащие в основе аномалии сильно влияют на вероятность спонтанного закрытия и диктуют необходимость дополнительного медикаментозного, хирургического или интервенционного лечения; поэтому в следующих разделах будут представлены послеоперационные, связанные с болезнью Крона и злокачественные ECF отдельно с их специфическими особенностями визуализации и терапевтическими подходами [ 1 , 2 , 3 , 6 ].
Послеоперационные кишечно-кожные свищи
Клинические особенности
Несмотря на улучшенные методы, большинство ECF в настоящее время развиваются после хирургических процедур, вторичных по отношению к несостоятельности анастомоза, нарушению восстановленной энтеротомии или непреднамеренному интраоперационному повреждению кишечника. В некоторых исследованиях сообщалось о вызывающей тревогу частоте (0,8–2%) послеоперационных ЭКФ, вероятно, в результате возрастающей сложности процедур, таких как циторедуктивная хирургия с перитонэктомией. В настоящее время большинство ЭКФ встречаются у больных, оперированных по поводу колоректального рака и рака яичников. В качестве альтернативы, ECF могут развиться после неонкологической хирургии, такой как вентральная герниопластика с использованием протезной сетки, или повторных лапаротомий, например, по поводу спаек и рецидивирующей кишечной непроходимости. По нашему опыту, большинство пациентов имели сложный анамнез, включающий множественные хирургические вмешательства [ 4 , 10 ]., 11 , 12 ].
Послеоперационные ECF могут проявляться рано (в течение первой послеоперационной недели) сочетанием септической лихорадки, тахикардии и гипотензии, дыхательной недостаточности, прогрессирующего вздутия кишечника, локализованной или диффузной болезненности в животе, ацидоза, лейкоцитоза и повышения С-реактивного белка. В качестве альтернативы, ECF могут проявляться поздно во время длительной послеоперационной госпитализации или после выписки в виде болезненных, эритематозных, флуктуирующих областей в хирургическом разрезе или в месте лапароскопического порта; в таких случаях медсестры часто замечают, что марля для лекарств становится влажной от желчи, кишечного содержимого или стула [ 2 ].
Рентгенофистулография: техника и внешний вид
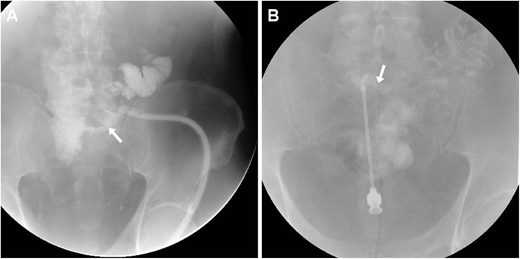
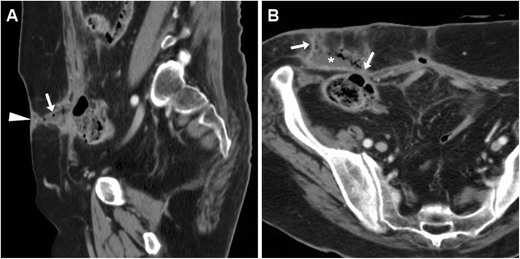
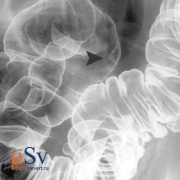
Фистулография (синография) традиционно представляла собой основной метод исследования ECF и в настоящее время остается полезным в качестве дополнительного метода для подтверждения связи между EFO и сегментом желудочно-кишечного тракта. По нашему опыту, эту технику лучше всего выполнять с помощью направившего хирурга, который зондирует EFO и вводит ECF. В зависимости от калибра могут использоваться венозная канюля или ангиографическая игла, стандартный шприц, катетер Фолея, педиатрический или назогастральный зонд для кормления. Затем под флюороскопическим контролем проводят ненасильственное ручное введение низкоосмолярного водорастворимого йодсодержащего контрастного вещества (КМ). Недорогая, быстрая и простая в выполнении фистулография непосредственно визуализирует сообщающуюся тонкую кишку (рис. 1 А, В) или сегмент толстой кишки (рис.1 C) и предоставляет информацию об анатомии ECF, такой как калибр, длина, ход и разветвления. Ложноотрицательные результаты исследований могут быть результатом отека, дебриса или сдавления абсцессом или образованием, препятствующим оттоку СМ в просвет кишечника. Однако при фистулографии отсутствует визуализация поперечного сечения пристеночной и экстралюминальной патологии вверх по течению, ниже по течению и в месте ECF [ 4 , 5 ].
Два примера фистулографии. Фистулография , выполненная через катетер, прокалываемый через наружное свищевое отверстие (ВНО), у мужчины 74 лет с повторными операциями в анамнезе по поводу кишечной непроходимости, спаек и несостоятельности анастомоза: оптимальная визуализация хода и длины кожно-кишечного свища (ЭКС). , стрелка), сообщается с подвздошной кишкой. B Фистулография с использованием иглы у 60-летнего ВИЧ-позитивного мужчины с недавним острым дивертикулитом толстой кишки: ECF (стрелка), сообщающаяся с сигмовидной кишкой, потребовала левосторонней гемиколэктомии и санации ECF
Методы КТ, внешний вид и дифференциальный диагноз
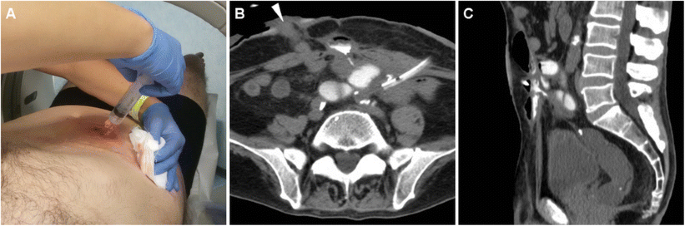
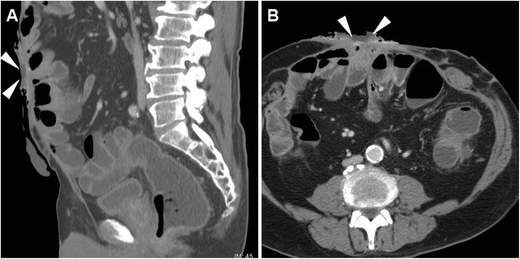
В настоящее время подавляющему большинству пациентов необходимо пройти КТ или МРТ, чтобы получить исчерпывающую перекрестную информацию о внеклеточной жидкости и лежащих в ее основе заболеваниях в качестве надежной основы для выбора и планирования соответствующего лечения. Мультидетекторная КТ предпочтительнее у пациентов, не готовых к сотрудничеству, или у тяжелобольных пациентов, таких как госпитализированные в раннем послеоперационном периоде, поскольку она позволяет получать изображения с высоким пространственным разрешением за секунды, тем самым ограничивая артефакты движения или перистальтики. В условиях ECF оправдано внутривенное введение КМ, если нет противопоказаний. Пероральное введение КМ помутнения может быть полезным у пациентов с дефицитом внутрибрюшного жира, чтобы облегчить дифференциацию петель кишечника от внепросветных структур и аномальных скоплений; к сожалению, большинство пациентов, недавно перенесших операцию, имеют кишечную непроходимость или непроходимость и не могут пить разбавленный СМ.2 ) с предварительной инъекцией йодированного CM, такого как 3% разбавленный йопамидол или йогексол, через EFO представляет собой полезный универсальный метод, который сочетает в себе информацию о поперечном срезе с затемнением пораженного кишечного тракта. Настоятельно рекомендуется реконструкция изображения и интерпретация исследования в сагиттальной плоскости, так как это обеспечивает наилучшую визуализацию вентральной брюшной стенки [ 4 , 5 ].
Методика КТ-фистулографии, выполняемая непосредственно на столе сканера путем ручного введения через ЭФО разбавленного КМ с помощью шприца и венозной канюли ( А ). Пример КТ-фистулографии ( Б , В ) у мужчины 69 лет с язвенным колитом, перенесенной правосторонней гемиколэктомией и повторной операцией по поводу осложнений: вскоре после закрытия илеостомы (обратите внимание на дренажную трубку) диагностирована маломощная ЭЦЖ, с коммуникацией между EFO (стрелка на B ) и затемненной подвздошной кишкой
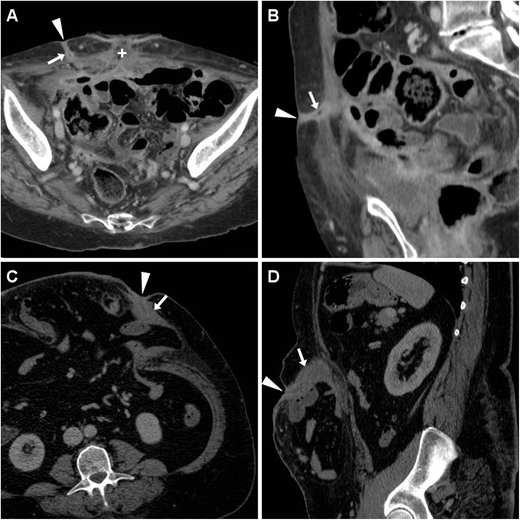
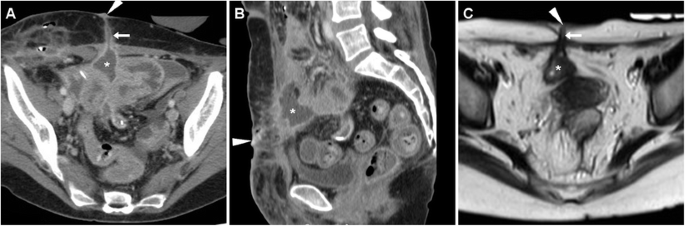
Обычный КТ-вид ECF (рис. 3 ) включает трубчатую структуру, происходящую из петли кишечника, которая направляется вентрально или вентро-латерально через брюшину, пересекает мышцы брюшной стенки и фасции, достигая поверхности кожи. ECF могут казаться либо разрушенными, либо открытыми с газообразным и/или жидким содержанием, что в последнем случае приводит к характерному внешнему виду «трамвайного пути». Стенки свища могут быть более или менее толстыми, иногда до одного сантиметра (рис. 3 , В, Г). Следует сообщать о формировании периферического абсцесса с жидкостным и газообразным содержимым вдоль пути ECF (рис. 4 ), поскольку он обычно изменяет терапевтический подход.
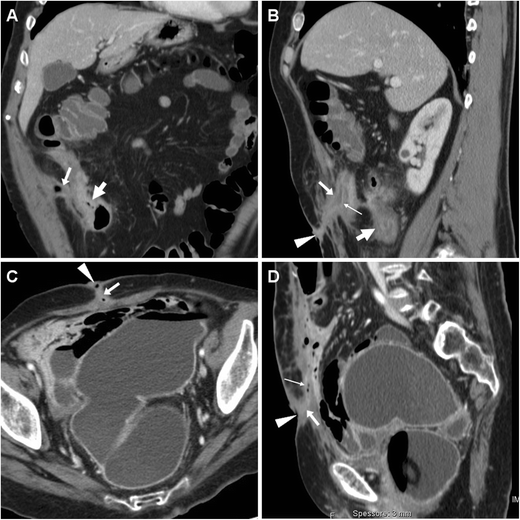
ECF в раннем послеоперационном периоде у 74-летней женщины после циторедуктивной операции по поводу распространенной карциномы эндометрия с карциноматозом брюшины. Характерные находки КТ ( А , В ) включали усиление парных структур «трамвайной дорожки» (стрелки), пересекающих брюшную полость через переднюю брюшную стенку к EFO (наконечники стрелок), отделенных от места недавнего лапаротомного доступа (+). ECF в конечном итоге зажила при длительном консервативном лечении в больнице.
Другой ECF, развившийся у 54-летней тучной женщины с постинцизионной абдоминальной эвисцерацией: соответствующий КТ ( C , D ) вид включал толстостенный увеличивающий свищ (стрелки), идущий от грыжи петли тонкой кишки к фокально втянутому EFO (стрелки). ). Хирургическое лечение включало санацию ЭКВ и сетчатую герниопластику.
Послеоперационная ЭКФ с формированием подкожного абсцесса у женщины 71 года после резекции дивертикулита сигмовидной кишки, осложнившегося несостоятельностью анастомоза, что потребовало повторной лапаротомии, резекции подвздошной кишки и временной илеостомы. КТ диагностировала сообщение (стрелки) между слепой кишкой и абсцессом (*), расположенным непосредственно над вентральными мышцами живота, стекающим в EFO (стрелка на А ). Хирургическое лечение включало илеоцекальную резекцию и ушивание абсцесса.
По нашему опыту, послеоперационные ECF часто развиваются у кахектичных пациентов с очень тонкой подкожной и мышечной плоскостями вентральной части живота после повторных операций. Вовлеченные петли кишечника имеют тенденцию сходиться к участку внеклеточной жидкости и плотно прилегать к серозной оболочке брюшины (рис. 2 и 5 ); нередко ECF развивается внутри послеоперационной грыжи (рис. 3 C, D).
Высокопроизводительная ECF у 69-летнего мужчины с повторными операциями в анамнезе по поводу перфорации тощей и двенадцатиперстной кишки при синдроме Золлингера-Эллисона с последующей гемиколэктомией, илеостомой и колостомой из-за ишемического некроза кишечника. На КТ широкая дренирующая EFO соответствовала 2-сантиметровому гипоаттенуирующему разрыву (указатели) в утолщенной коже, тесно прилегающему к растянутым петлям кишечника с уровнями воздуха и жидкости, соответствующими послеоперационной кишечной непроходимости.
На КТ EFO обычно соответствует фокальной кожной ретракции или депрессии и часто окружен утолщенной воспаленной кожей (рис. 3 и 4 ); альтернативно, может наблюдаться явный кожный разрыв или прерывистость, особенно в высокоэффективных ECF (рис. 5 ).
Два ключевых дифференциальных диагноза КТ ECF представлены:
- Недавний лапаротомный разрез (рис. 3А ), который дифференцируется путем просмотра хирургического описания и осмотра брюшной полости пациента, и
- Те свищи (с обычным «трамвайным» КТ-видом), которые дренируют наружу внутрибрюшной послеоперационный сбор (рис. 6 А, Б), но не имеют сообщения с кишечником.
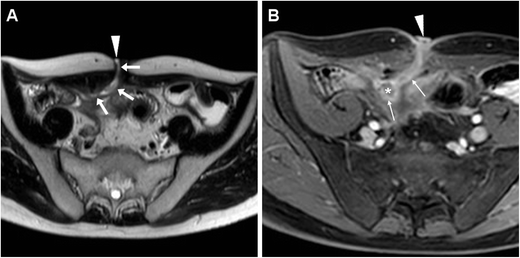
Два примера послеоперационных свищей, дренирующих внутрибрюшные скопления без вовлечения кишечника. У 34-летней женщины после илеоцекальной резекции КТ ( A , B ) показала EFO (наконечники стрелок), сообщающийся через фистулу «трамвайный путь» (стрелки) через брюшную стенку с периферически увеличивающимся сбором (*), который в конечном итоге решено. У 48-летней женщины с недавней резекцией БК на Т2-взвешенной МРТ ( С ) визуализировался хронический послеоперационный скопление (*), соединенное с кожей фистулой (стрелки).
Техника МРТ и результаты
Основываясь на обширном опыте лечения перианальных фистул, МРТ имеет более высокий контраст мягких тканей по сравнению с КТ и, следовательно, может лучше определять свищевой ход; кроме того, МРТ привлекательна как для рентгенологов, так и для пациентов из-за отсутствия воздействия ионизирующего излучения. Однако у пациентов в критическом состоянии, например в первые послеоперационные дни, проведение МРТ затруднено из-за респираторных и перистальтических артефактов из-за непроходимости кишечника или асцита. У пациентов, которые могут в достаточной степени сотрудничать, протоколы МРТ для исследования ECF должны основываться на многоплоскостных, чувствительных к жидкости Т2-взвешенных изображениях, включая переднюю брюшную стенку; рекомендуется использование методов подавления жира по крайней мере в одной плоскости для улучшения выявления отека и воспаления в интраабдоминальной и подкожной жировой клетчатке. Кроме того,
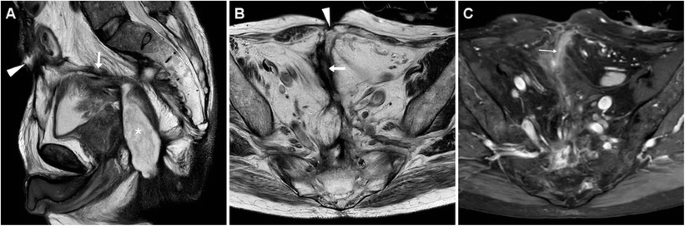
На сильно Т2-взвешенных МРТ ЭЦЖ видна как заполненная жидкостью гиперинтенсивная трубчатая структура, проходящая через брюшную стенку и подкожно-жировую клетчатку, чтобы достичь EFO. Стенки свищей показывают переменную, как правило, промежуточную интенсивность сигнала как на Т1-, так и на Т2-взвешенных изображениях с соответствующим усилением «трамвайного следа» (рис. 7 ) на изображениях после введения гадолиния. Со временем персистирующие ECF имеют тенденцию к развитию более толстых стенок с более низким T2-взвешенным сигналом от фиброза и уменьшением интенсивности контрастного усиления. К сожалению, по нашему опыту, идентификация наличия или отсутствия кишечной коммуникации обычно более сложна при МРТ (рис. 6 C, D) по сравнению с КТ [ 4 , 5 ].
МРТ-диагностика послеоперационной ЭКФ у мужчины 65 лет с длительно существующей фистулизирующей БК, ранее перенесшей брюшно-промежностную резекцию по поводу перианальных свищей, осложненных анальной плоскоклеточной карциномой (АСК). На Т2-взвешенных изображениях было видно, что заполненная жидкостью ECF (стрелки) движется вентрально, чтобы достичь вентральной EFO (наконечники стрелок) в месте предыдущего хирургического разреза, от вершины большого Т2-гиперинтенсивного образования (* на А ), соответствующего к рецидивирующему ИСС. Т1-взвешенное изображение ( С ) после подавления жира гадолинием показало гиперконсистенцию слизистой оболочки (тонкая стрелка) вдоль свищевого хода.
Уход
В настоящее время большинство послеоперационных ЭКФ излечиваются с помощью консервативных мер, эндоскопической или чрескожной терапии. Последние заключаются в местных инъекциях герметиков, таких как цианоакриловый клей (Glubran 2, GEM, Виареджо, Италия), и быстро становятся предпочтительным вариантом, поскольку достигают терапевтического успеха за один сеанс почти в двух третях случаев без каких-либо осложнений. [ 5 , 13 ].
Эндоскопическое позиционирование клипс и стентов является основным вариантом при наличии несостоятельности кишечного анастомоза. Хирургическое восстановление в настоящее время зарезервировано для избранных случаев и по-прежнему связано со значительной заболеваемостью; требуется высокая квалификация для выполнения спаек и резекций кишки у внутреннего свищевого отверстия; к сожалению, послеоперационный рецидив ЭКФ не является редкостью (16–21% случаев) [ 3 , 14 ].
Кожно-кишечные свищи при хронических воспалительных заболеваниях кишечника
Клинические особенности
У пациентов с ВЗК кожно-кишечные свищи могут быть как спонтанными, так и послеоперационными. Первая ситуация возникает в результате характерного трансмурального воспаления пораженной стенки кишечника, которое приводит к проникновению в соседние ткани, иногда вовлекает брюшную стенку и в конечном итоге может достигать поверхностных тканей. В подавляющем большинстве случаев ЭКФ возникают из пораженного дистального отдела подвздошной кишки и связаны с длительно существующей или активной фистулирующей БК; в исключительных случаях ЭЦФ может быть начальным проявлением невыявленного ВЗК. Несмотря на редкость, БК по-прежнему представляет собой основную причину неятрогенных ECF и поэтому ее следует подозревать при незаживающем спонтанном свище у молодого или среднего возраста, в остальном здорового пациента [ 15 , 16 ].
Изображение поперечного сечения
Согласно заявлениям Европейской организации Крона и колита (ECCO), КТ- и МР-энтерография с расширением полости рта представляют собой идеальные методы визуализации для диагностики и последующего наблюдения БК с аналогичными показаниями и диагностической точностью; последний метод используется все чаще, поскольку он не использует ионизирующее излучение. У отдельных пациентов мультидетекторная КТ с водяной клизмой может быть полезна для визуализации степени, пристеночных и внепросветных изменений ВЗК толстой кишки. В неотложных состояниях стандартная КТ с контрастным усилением широко используется и очень полезна при подозрении на острые осложнения БК, такие как перфорация, обструкция, свищ или образование абсцесса [ 17 , 18 ].
В частности, у пациентов с пенетрирующей болезнью Крона передняя брюшная стенка должна быть тщательно изучена при поперечных визуализирующих исследованиях. Иногда неожиданные или малозаметные ECF распознаются на КТ как «трамвайные пути» с жидким и/или газообразным содержимым (рис. 8 ), которые обычно отходят от места активного заболевания, кишечно-кишечных свищей или рецидива анастомозной БК. С помощью МРТ заполненные жидкостью внеклеточные жидкости хорошо распознаются по пути от кишечника к коже (рис. 9 ). В условиях активного ВЗК характерным проявлением является усиление контраста слизистой оболочки, которое обычно заметно и оценивается как на КТ (рис. 8 ), так и на последовательностях МРТ с подавлением жира (рис. 9 и 10 ).). Абсцедирование характерно для БК чаще, чем при послеоперационных ЭКФ: при обеих модальностях абсцессные скопления с периферическим усилением и смешанным воздухом, жидкостью и плотным содержимым легко выявляются как во внутреннем отверстии, так и по ходу подкожного хода (рис. 10 ). ) [ 19 , 20 ].
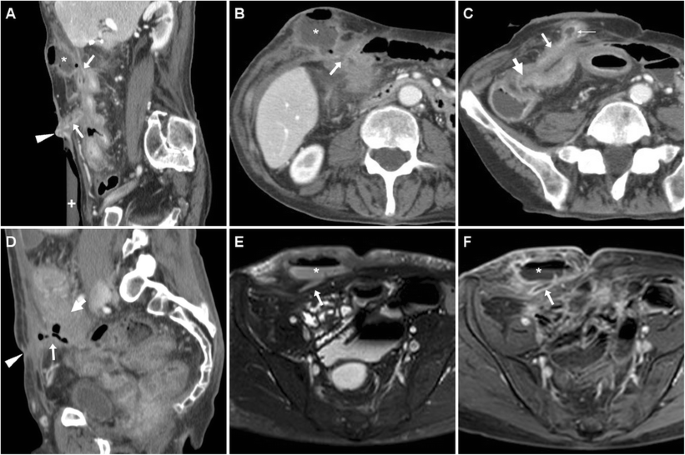
Два случая спонтанной ЭЦЖ с низким выбросом при БК. У 59-летнего мужчины с илеоцекальной резекцией в анамнезе почти 20 лет назад, КТ ( A , B ) определила правостороннюю ECF как усиленную фистулу «трамвайного пути» (стрелки) с гиперконсистенцией слизистой оболочки (тонкая стрелка). , который отходил от утолщенной преанастомозной подвздошной кишки (толстая стрелка) при рецидивирующей БК и пересекал брюшную стенку и подкожно-жировую клетчатку до ЭФО (указатели стрелок); проведена повторная резекция подвздошно-кишечной кишки и санация ВЧП
У 62-летней женщины, перенесшей несколько операций, КТ с водяной клизмой ( C , D — обратите внимание на растянутую ректосигмовидную кишку с ректальной трубкой) показала парамедианную гипогастральную ECF с гиперконтрастированием слизистой оболочки (тонкая стрелка) и фокально сниженным EFO (стрелки), сообщающимся со спавшейся подвздошной кишкой; пациент хорошо перенес терапию инфликсимабом
Спонтанный ECF у 37-летнего мужчины со стриктурирующим и фистулирующим БК, показанный при МР-энтерографии в виде жидкоподобного T2-гиперинтенсивного следа (стрелки на A ), идущего от петли подвздошной кишки через брюшную стенку и, наконец, достигающего EFO (наконечники стрел). Т1-взвешенное изображение ( В ) после введения гадолиния с подавлением жира показало гиперконсистенцию слизистой вдоль дорожки ECF (тонкие стрелки) и в месте внутреннего отверстия (*). Хирургическое лечение потребовало санации свища и стриктуропластики.
Два случая спонтанной внеклеточной жидкости, осложненной абсцедирующими скоплениями при хронических воспалительных заболеваниях кишечника. У 77-летнего мужчины с неопределенным колитом, пролеченного путем проктоколэктомии и окончательной илеостомы, развились два ECF, один в правом подреберье с обширным поверхностным абсцессом (* на A , B ), сообщающимся (стрелки) с петлей тощей кишки; вторая, более длинная и более дистальная ECF (стрелка на C ), происходила из утолщенной подвздошной кишки (толстая стрелка) и включала меньший подкожный абсцесс с воспаленной слизистой оболочкой (тонкая стрелка). У 59-летней женщины с БК со фистулами ЭЦЖ соответствовала на КТ ( D) к заполненному газом следу (стрелка), отходящему от больного подвздошно-ободочного анастомоза (толстая стрелка) и достигающему едва уловимой вдавленной EFO (наконечник стрелки). Последующая МРТ, включая Т2- ( E ) и постконтрастную насыщенную жиром Т1-взвешенную ( F ), показала развитие большого абсцесса (*) с содержимым жидкости и усиленной стенкой вдоль ECF (стрелки); радикальное хирургическое лечение потребовало обширного расслоения спаек, резекции прямой кишки и пораженной перианастомозной кишки.
Послеоперационные кожно-кишечные свищи при БК
В качестве альтернативы, ЭЦФ может возникнуть в течение нескольких недель или месяцев после операции по поводу ВЗК, часто из-за предшествующего рубца на брюшной полости и без остаточного или рецидивирующего заболевания; клинически эта ситуация обычно связана с ограниченными физическими данными из-за использования стероидов или иммуномодуляторов.
У пациентов, недавно перенесших хирургическое вмешательство, мультидетекторная КТ (рис. 11 A–C) предпочтительнее для подтверждения и визуализации ECF с аналогичными результатами визуализации, что и их спонтанные аналоги. К сожалению, интерпретация изображений поперечного сечения вскоре после операции ВЗК, как правило, затруднена из-за сочетания ограниченного внутрибрюшного жира и послеоперационных изменений, таких как диффузный отек в месте резекции и в брыжейке, перитонеальная жидкость и усиление СМ; по нашему опыту, это особенно верно для МРТ (рис. 11 D-F) [ 15 , 16 ].
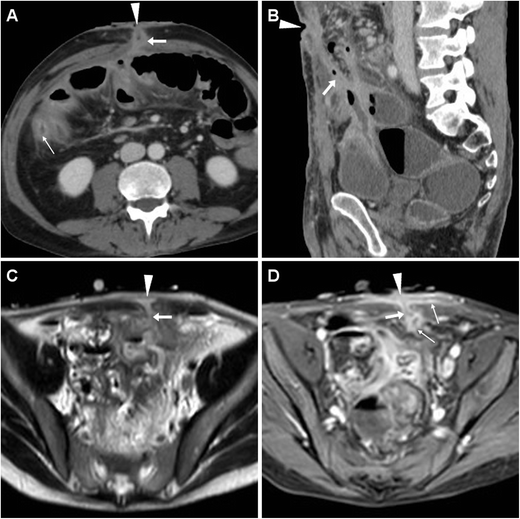
Два случая послеоперационной ECF при БК. После недавней илеоцекальной резекции у 61-летнего мужчины многоплоскостная КТ-энтерография ( А , В ) показала утолщение стенки с усилением слизистой оболочки (тонкие стрелки) вдоль дистального отдела подвздошной кишки, что согласуется с активностью заболевания, и внеклеточную жидкость (стрелки), проходящую косо от пораженный тракт к мелкому мезогастральному ЭФО (указатели); повторная операция включала санацию ВЧП, резекцию подвздошной кишки и повторное наложение анастомоза. У мужчины 27 лет после субтотальной колэктомии с анастомозом слепой кишки с соответствующей МРТ (Т2-взвешенное изображение С , постконтрастное Т1-взвешенное изображение с подавлением жира D) появление заполненного жидкостью следа (стрелки) с периферическим усилением (тонкие стрелки). Выраженное воспаление также затронуло кожу вокруг EFO (стрелки) и на внутренней поверхности ECF: последняя эндоскопически соответствовала месту анастомоза и лечилась путем установки клипсы вне эндоскопа, что позволяло разрешить ECF.
Уход
Оптимальное лечение кишечно-кожных фистул при БК остается дискуссионным: в прошлом обычно выполнялась хирургическая резекция пораженной кишки плюс санация свищей через брюшную стенку и подкожные слои. В последнее десятилетие медикаментозная терапия изменилась с введением биопрепаратов и иммуномодуляторов. Исходя из опыта лечения перианальных воспалительных заболеваний, все чаще используются моноклональные антитела к фактору некроза опухоли: при правильном отборе пациентов, при отсутствии стеноза и сложных свищей инфликсимаб дает хороший ответ в послеоперационных и, в меньшей степени, спонтанных ЭЦФ [ 16 , 21 , 22 ].
Особая ситуация: злокачественные свищи при болезни Крона
У пациентов с длительно текущим БК аденокарцинома тонкой кишки (SBAC) встречается в 33 раза чаще, чем в общей популяции. К сожалению, его неспецифические проявления имитируют проявления активной или обструктивной БК, что часто приводит к запоздалой диагностике на поздних стадиях диссеминированного заболевания [ 23 , 24 ].
Иногда SBAC может проникать через переднюю брюшную стенку и образовывать свищи на коже (рис. 12 ), ситуация, которая легко интерпретируется как обычная, спонтанная, связанная с CD, ECF, если не будет получена тщательная визуализация. К сожалению, дифференцировать SBAC от острого воспалительного или фиброзного CD сложно. Наиболее распространенные паттерны визуализации поперечного сечения включают образование подвздошной кишки, длинную стриктуру с неоднородной подслизистой оболочкой, короткий тяжелый стеноз с дилатацией восходящего отдела кишки, неравномерное асимметричное периферическое утолщение. Подозрительные признаки включают толщину стенки > 1 см, резкий «плечевой» переход, утрату стратификации стенки, затухание мягких тканей или интенсивность солидного МРТ-сигнала, неравномерную узловатость серозной оболочки и аденопатии (рис. 12 ) [ 25 ,26 , 27 ].
Подвздошная аденокарцинома со свищами на коже у 68-летнего мужчины с длительно существующей болезнью Крона, предшествующей резекцией илеоцекального отдела, недавней потерей веса и двумя дренирующими EFO на передней брюшной стенке. КТ-энтерография подтвердила двойную вентральную ЭЦЖ (стрелки) из заметно утолщенного нерасслоенного сегмента подвздошной кишки (толстые стрелки). Опухолевая инфильтрация передней брюшной стенки была патологически подтверждена после хирургической резекции единым блоком. Прогрессирование опухоли с асцитом и метастазами в печень (не показано) в конечном итоге развилось (Частично воспроизведено из открытого доступа, ссылка № [ 34 ])
Редкую возможность SBAC следует учитывать у пациентов с ухудшением симптомов целиакии после длительного покоя и при незаживающих ECF, несмотря на лечение. Несмотря на сложность, предоперационная диагностика злокачественной внеклеточной жидкости при БК влияет на лечение, поскольку требует резекции единым блоком в сочетании с химиотерапией [ 23 , 24 ]. В качестве альтернативы, иногда сообщалось о развитии плоскоклеточной карциномы при хронической болезни внеклеточной жидкости, связанной с болезнью Крона [ 28 ].
облучение
Хотя у большинства пациентов, получающих облучение брюшной полости или таза, развивается лучевой энтерит в той или иной степени, постлучевые ECF становятся все более редкими и развиваются по крайней мере через 4–6 месяцев после лучевой терапии. К сожалению, облучение еще больше усложняет лечение из-за сочетания трех факторов: а) низкая вероятность спонтанного закрытия; б) плохое заживление и высокий риск расхождения швов после операции на облученной кишке; в) отсроченная или невозможная адъювантная или паллиативная терапия в присутствии ECF [ 4 ].
Кожно-кишечные свищи, связанные с опухолью
При возникновении спонтанной внеклеточной жидкости у взрослого или пожилого пациента без недавних хирургических вмешательств или ВЗК в анамнезе следует учитывать возможность основного злокачественного новообразования. Эта ситуация становится все более редкой, поскольку большинство колоректальных злокачественных новообразований в настоящее время диагностируются и лечатся на ранней или доклинической стадии, но они тесно связаны (более 50% случаев) с диссеминированным заболеванием, ухудшением качества жизни и высокой 30-дневной смертностью [ 29 , 30 ]. ].
Связанные с опухолью ECF являются результатом либо суперинфекции (рис. 13 ), либо образования фистул через мышцы брюшной стенки (рис. 14 ). В обоих случаях КТ и МРТ имеют решающее значение для выявления твердых, более или менее однородных и усиливающих неопластические образования (рис. 13 ) и возможного наличия скоплений абсцесса, требующих дренирования. В качестве альтернативы, визуализация поперечного сечения предполагает колоректальную опухоль, связанную с ECF, при наличии неравномерного или асимметричного утолщения стенки (рис. 14 ); такие особенности, как короткое сегментарное поражение, резкий переход, потеря стратификации стенок и лимфаденопатия, дополнительно подтверждают диагноз злокачественного новообразования [ 31 , 32 , 33 ].
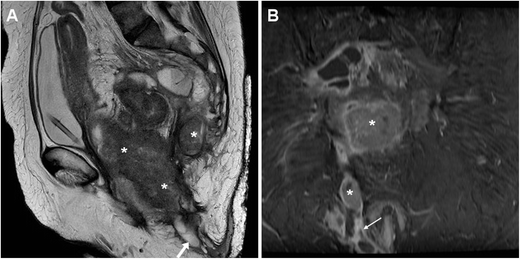
Местно-распространенный рак прямой кишки с суперинфекцией и образованием внеклеточной жидкости у 54-летней женщины с септической лихорадкой. Т2-взвешенные изображения МРТ ( А ) показали большую солидную опухоль (*), прорастающую во влагалище и промежность. Кроме того, ЭЦЖ шириной 1 см (стрелки) шла задне-нижне к перианальной коже и показала периферическое усиление (тонкая стрелка) на Т1-взвешенном изображении после подавления жира гадолинием ( В )
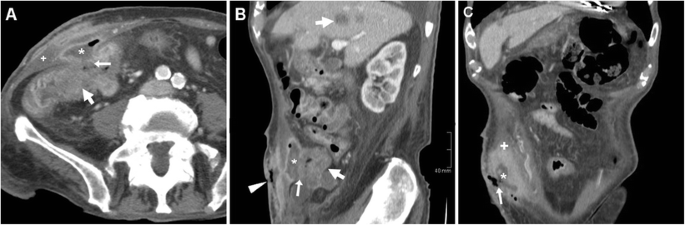
Кожный свищ карциномы толстой кишки у 92-летнего мужчины с усилением правосторонней боли и болезненности в животе. КТ выявила сегментарное нерасслоенное периферическое утолщение (толстые стрелки) в восходящей ободочной кишке, которое инфильтрировало брюшину, открывалось (стрелки на A , B ) в абсцесс (*) в воспаленной брюшной стенке (+) и сообщалось с EFO кожи (стрелка на B ) через ECF (стрелка на C ). Имеются метастазы в печень (жирная стрелка). Пациент получил поддерживающее лечение с размещением мешка типа колостомы в EFO (частично воспроизведено из открытого доступа, ссылка № [ 35 ])
Идеальной лечебной операцией является удаление единым блоком свищящей опухоли вместе с пораженной брюшной стенкой вдоль пути ECF, плюс производная колостома или илеостомия. Альтернативные варианты включают паллиативную резекцию, шунтирование или стому при нерезектабельных опухолях [ 10 , 30 ].
Вывод
В настоящее время большинству пациентов с ECF проводят мультидетекторную КТ или МРТ, чтобы обеспечить всестороннюю поперечную оценку в качестве постоянной основы для выбора и планирования соответствующего лечения. Фактически, визуализация основных состояний (таких как послеоперационная несостоятельность анастомоза, кишечная непроходимость, абсцессы, поддающиеся дренированию, активная или стриктурирующая БК, фистулизирующая или рецидивирующая опухоль) позволяет проводить направленное лечение, что приводит к снижению частоты неэффективного консервативного лечения и более высокой вероятности терапевтический успех [ 4 , 5 ].
Литература
-
Murphy J, Hotouras A, Koers L et al (2013) Establishing a regional enterocutaneous fistula service: the Royal London hospital experience. Int J Surg 11:952–956
-
Orangio GR (2010) Enterocutaneous fistula: medical and surgical management including patients with Crohn’s disease. Clin Colon Rectal Surg 23:169–175
-
Visschers RG, van Gemert WG, Winkens B et al (2012) Guided treatment improves outcome of patients with enterocutaneous fistulas. World J Surg 36:2341–2348
-
Felipe de Campos-Lobato L, Vogel JD (2010) Enterocutaneous fistula associated with malignancy and prior radiation therapy. Clin Colon Rectal Surg 23:176–181
-
Lee JK, Stein SL (2010) Radiographic and endoscopic diagnosis and treatment of enterocutaneous fistulas. Clin Colon Rectal Surg 23:149–160
-
Gyorki DE, Brooks CE, Gett R et al (2010) Enterocutaneous fistula: a single-centre experience. ANZ J Surg 80:178–181
-
Williams LJ, Zolfaghari S, Boushey RP (2010) Complications of enterocutaneous fistulas and their management. Clin Colon Rectal Surg 23:209–220
-
Gu GL, Wang L, Wei XM et al (2014) Necrotizing fasciitis secondary to enterocutaneous fistula: three case reports. World J Gastroenterol 20:7988–7992
-
Redden MH, Ramsay P, Humphries T et al (2013) The etiology of enterocutaneous fistula predicts outcome. Ochsner J 13:507–511
-
Chamberlain RS, Kaufman HL, Danforth DN (1998) Enterocutaneous fistula in cancer patients: etiology, management, outcome, and impact on further treatment. Am Surg 64:1204–1211
-
Foda M, Carlson MA (2009) Enterocutaneous fistula associated with ePTFE mesh: case report and review of the literature. Hernia 13:323–326
-
Tonolini M, Ippolito S (2016) Multidetector CT of expected findings and early postoperative complications after current techniques for ventral hernia repair. Insights Imaging 7:541–551
-
Mauri G, Pescatori LC, Mattiuz C et al (2017) Non-healing post-surgical fistulae: treatment with image-guided percutaneous injection of cyanoacrylic glue. Radiol Med 122:88–94
-
Lee SH (2012) Surgical management of enterocutaneous fistula. Korean J Radiol 13(Suppl 1):S17–S20
-
Cellini C, Safar B, Fleshman J (2010) Surgical management of pyogenic complications of Crohn’s disease. Inflamm Bowel Dis 16:512–517
-
Gomez-Senent S, Barreiro-de-Acosta M, Garcia-Sanchez V (2013) Enterocutaneous fistulas and Crohn s disease: clinical characteristics and response to treatment. Rev Esp Enferm Dig 105:3–6
-
Panes J, Bouhnik Y, Reinisch W et al (2013) Imaging techniques for assessment of inflammatory bowel disease: joint ECCO and ESGAR evidence-based consensus guidelines. J Crohns Colitis 7:556–585
-
Norsa AH, Tonolini M, Ippolito S et al (2013) Water enema multidetector CT technique and imaging of diverticulitis and chronic inflammatory bowel diseases. Insights Imaging 4:309–320
-
Griffin N, Grant LA, Anderson S et al (2012) Small bowel MR enterography: problem solving in Crohn’s disease. Insights Imaging 3:251–263
-
Baker ME, Hara AK, Platt JF et al (2015) CT enterography for Crohn’s disease: optimal technique and imaging issues. Abdom Imaging 40:938–952
-
Fries W, La Malfa G, Costantino G et al (2011) Combined approach with biologics and surgery for enterocutaneous fistulas in Crohn’s disease. Inflamm Bowel Dis 17:671–673
-
Amiot A, Setakhr V, Seksik P et al (2014) Long-term outcome of enterocutaneous fistula in patients with Crohn’s disease treated with anti-TNF therapy: a cohort study from the GETAID. Am J Gastroenterol 109:1443–1449
-
Elriz K, Carrat F, Carbonnel F et al (2013) Incidence, presentation, and prognosis of small bowel adenocarcinoma in patients with small bowel Crohn’s disease: a prospective observational study. Inflamm Bowel Dis 19:1823–1826
-
Widmar M, Greenstein AJ, Sachar DB et al (2011) Small bowel adenocarcinoma in Crohn’s disease. J Gastrointest Surg 15:797–802
-
Place V, Hristova L, Dray X et al (2012) Ileal adenocarcinoma in Crohn’s disease: magnetic resonance enterography features. Clin Imaging 36:24–28
-
Soyer P, Hristova L, Boudghene F et al (2012) Small bowel adenocarcinoma in Crohn disease: CT-enterography features with pathological correlation. Abdom Imaging 37:338–349
-
Weber NK, Fletcher JG, Fidler JL et al (2015) Clinical characteristics and imaging features of small bowel adenocarcinomas in Crohn’s disease. Abdom Imaging 40:1060–1067
-
Pinto Pais T, Fernandes S, Carvalho J (2014) Squamous cell carcinoma in enterocutaneous fistula associated with Crohn’s disease: first case report. J Crohns Colitis 8:1142–1143
-
Gunay Y, Bircan H, Demiralay E et al (2013) Spontaneous enterocutaneous fistula: unusual presentation of colon cancer. Turk J Gastroenterol 24:458–459
-
Osian G (2012) Emergency Surgery for Colorectal Cancer Complications: Obstruction, Perforation, Bleeding. Contemporary Issues in Colorectal Surgical Practice, Dr Yik-Hong Ho (Ed) InTech, Available from: http://www.intechopen.com/books/contemporary-issues-in-colorectal-surgicalpractice/emergency-surgery-for-colorectal-cancer-complications
-
Catalano O (1997) Perforated carcinoma of the colorectum. Computerized tomography findings. Radiol Med 93:83–86
-
Kim SW, Shin HC, Kim IY et al (2010) CT findings of colonic complications associated with colon cancer. Korean J Radiol 11:211–221
-
Tonolini M, Bianco R (2013) MRI and CT of anal carcinoma: a pictorial review. Insights Imaging 4:53–62
-
Tonolini M, Sampietro G (2016) Malignant enterocutaneous fistula in Crohn’s disease {Online}. EuroRAD http://www.eurorad.org/case.php?id=13194
-
Tonolini M (2016) Spontaneous cutaneous fistulisation of colon carcinoma {Online}. EuroRAD http://www.eurorad.org/case.php?id=13353
Оригинал статьи https://insightsimaging.springeropen.com/articles/10.1007/s13244-017-0572-3