Мигрень: характеристика заболевания, биомаркеры и точная медицина
Мигрень — это неврологическое расстройство, приводящее к инвалидности, диагноз которого основывается на клинических критериях. Недостатком этих критериев является то, что они не полностью отражают неоднородность мигрени, включая лежащие в ее основе генетические и нейробиологические факторы. Эта сложность дала импульс исследованиям биомаркеров с целью улучшения характеристик болезни и определения новых лекарственных препаратов.
В этой серии статей мы представляем прогресс, достигнутый в поиске биомаркеров мигрени в рамках генетики, моделирования провокаций, биохимии и нейровизуализационных исследований. Кроме того, мы описываем проблемы и будущие направления для каждой модальности биомаркера. Мы также обсуждаем успехи, достигнутые в объединении и интеграции данных из нескольких модальностей биомаркеров.
Введение
Мигрень — широко распространенное неврологическое заболевание, которое во всем мире считается второй ведущей причиной долгих лет жизни с инвалидностью. Патогенез мигрени имеет сильную генетическую составляющую и включает активацию тригеминоваскулярных болевых путей. Мигрень определяется исключительно клиническими критериями, которые стимулировали исследовательские усилия по установлению специфических биомаркеров мигрени для подходов точной медицины.Достижения в области генетики, моделей провокации, биохимии и нейровизуализации открывают большие перспективы и улучшили наше понимание патогенеза мигрени. В этой серии статей мы сначала оцениваем прогресс, достигнутый в поиске биомаркеров, специфичных для мигрени. Во-вторых, мы обсуждаем использование интеграции данных из нескольких модальностей биомаркеров для более точной оценки различных и уникальных особенностей мигрени. Наконец, мы выделяем проблемы, связанные с текущими подходами к биомаркерам, и даем рекомендации по улучшению исследований биомаркеров мигрени.
Классификация и характеристика мигрени
Диагноз мигрени основывается на клинических критериях, приведенных в третьем издании Международной классификации расстройств головной боли (ICHD-3).6 Анамнез болезни является основным компонентом диагноза, и типичные клинические признаки включают повторяющиеся приступы головной боли односторонней локализации, пульсации, средней или тяжелой интенсивности, ухудшение от повседневной физической активности и связь с тошнотой, рвотой, светобоязнью и фонофобией.6 Хотя мигренозная боль часто распространяется с одной стороны головы, примерно 40% пациентов сообщают о двусторонней мигренозной боли.7 Однако мигрень — это гетерогенное заболевание с множеством субфенотипов;6Таким образом, ICHD-3 определил клинические критерии мигрени без ауры, мигрени с аурой и более редких субфенотипов ( панель 1 ).6Люди, страдающие мигренью, чаще всего проходят нормальный физический осмотр, при этом никаких результатов, указывающих на другую первопричину головной боли, не обнаружено. Поэтому нейровизуализация редко требуется при диагностических исследованиях.8
Критерии диагностики мигрени ICHD-3
Мигрень без ауры
- Критерий A: не менее пяти атак, соответствующих критериям B – D.
- Критерий B: приступы головной боли продолжительностью 4–72 ч (при отсутствии лечения или безуспешного лечения)
- Критерий C: головная боль имеет как минимум две из следующих четырех характеристик:
- Одностороннее расположение
- Пульсирующее качество
- Умеренная или сильная интенсивность боли
- Ухудшение от обычной физической активности (например, от ходьбы или подъема по лестнице) или из-за ее отказа
- Критерий D: во время головной боли хотя бы одно из следующего:
- Тошнота, рвота или и то, и другое.
- Светобоязнь и фонофобия
- Критерий E: не лучше объяснить другим диагнозом ICHD-3
Мигрень с аурой
- Критерий A: минимум две атаки, соответствующие критериям B и C
- Критерий B: один или несколько из следующих полностью обратимых симптомов ауры:
- Визуальный
- Сенсорный
- Речь или язык
- Мотор
- Мозговой ствол
- Сетчатка
- Критерий C: не менее трех из следующих шести характеристик:
- По крайней мере, один симптом ауры распространяется постепенно в течение ≥5 мин.
- Два или более симптома ауры возникают последовательно
- Каждый отдельный симптом ауры длится 5–60 мин.
- По крайней мере, один симптом ауры односторонний.
- По крайней мере, один симптом ауры положительный
- Аура сопровождается или сопровождается головной болью в течение 60 минут.
- Критерий D: не лучше объясняется другим диагнозом ICHD-3
Хроническая мигрень
- Критерий A: головная боль (мигрень или тип напряжения) ≥15 дней в месяц в течение> 3 месяцев и выполнение критериев B и C
- Критерий B: возникает у пациента, у которого было не менее пяти приступов, отвечающих критериям B – D для мигрени без ауры или критериям B и C для мигрени с аурой.
- Критерий C: ≥8 дней в месяц в течение> 3 месяцев, выполнение любого из следующих условий:
- Критерии C и D при мигрени без ауры
- Критерии B и C при мигрени с аурой
- Пациент считает, что в начале мигрень имеет мигрень, которая облегчается приемом триптана или производного спорыньи.
- Критерий D: не лучше объясняется другим диагнозом ICHD-3
Вероятная мигрень
- Критерий A: приступы, соответствующие всем критериям A – D для мигрени без ауры, кроме одного, или всем критериям A – C, кроме одного, для мигрени с аурой.
- Критерий B: несоответствие критериям ICHD-3 для любого другого расстройства головной боли.
- Критерий C: не лучше объясняется другим диагнозом ICHD-3
ICHD-3 = Международная классификация заболеваний головной боли, третье издание.
Аура возникает примерно у одной трети людей с мигренью и характеризуется преходящими очаговыми неврологическими симптомами повторяющегося характера, которые постепенно развиваются в течение 5–60 минут.6 Визуальные симптомы (например, скотома или спектры фортификации) являются наиболее частым клиническим проявлением ауры, встречающимся более чем у 90% людей с мигренью с аурой. Менее распространены сенсорные симптомы (например, парестезия) и нарушения речи или языка, которые обычно присутствуют в сочетании с симптомами зрительной ауры. Хотя фаза ауры обычно наступает до начала головной боли, некоторые данные свидетельствуют о том, что симптомы ауры относительно часты также во время или при отсутствии головной боли. Другой важный аспект классификации мигрени — это диагностика хронической мигрени.6 ICHD-3 определяет хроническую мигрень как головную боль, возникающую 15 или более дней в месяц, из которых не менее 8 дней соответствуют клиническим критериям мигрени с аурой или без нее.6
Поскольку мигрень все чаще признается как гетерогенное заболевание, ICHD-3 предоставил клинические критерии вероятной мигрени, которые позволяют поставить диагноз, ожидающий подтверждения во время ранней клинической оценки.
Генетические биомаркеры
Мигрень часто группируется в семьях, что свидетельствует о сильном генетическом компоненте ее патогенеза.2Однако идентификация соответствующих генов остается проблемой. Популяционные исследования близнецов и семей показали, что мигрень является сложным неврологическим заболеванием, особенности которого, вероятно, связаны с взаимодействием ген-ген и ген-среда, а также с другими неизвестными факторами. Полногеномный метаанализ ассоциации выявил 38 геномных локусов, которые влияют на риск мигрени.10Этот метаанализ также обнаружил обогащение вариантов риска мигрени генами, экспрессируемыми в тканях с компонентами сосудистых и гладкомышечных клеток. Этот вывод согласуется с предыдущими сообщениями об общей генетической основе мигрени с ишемическим инсультом и ишемической болезнью сердца.
Сводный анализ подтвердил наличие обогащения сердечно-сосудистой системы у лиц с мигренью, хотя анализ данных по хроматину также дал доказательства в поддержку обогащения нейронов. Основываясь на этих выводах, будущий анализ множества тканей должен подчеркивать представление максимально возможного количества тканей и типов клеток.
Генетические исследования также предоставили механистические идеи для улучшения понимания субфенотипов мигрени. При анализе 1589 семей с мигренью высокая полигенная нагрузка была связана с повышенной тяжестью мигрени, более ранним возрастом начала и мигренью с аурой. Следует отметить, что одного семейного анамнеза мигрени может быть достаточно, чтобы сделать аналогичные оценки, поскольку повышенная распространенность мигрени в семье была связана с более ранним возрастом начала, мигренью с аурой и увеличением количества дней приема лекарств.
Также важна оценка эпигенетического вклада в патогенез мигрени. Полногеномный ассоциативный анализ количественно определил паттерны метилирования ДНК при мигрени и обнаружил 62 независимых дифференциально метилированных участка.17Однако в этом исследовании не проводилось различий между мигренью с аурой и без нее. Необходимы дальнейшие исследования, потому что исследование эпигенетического вклада в мигрень все еще находится в зачаточном состоянии.
Стратификация по генетике позволила улучшить биомаркеры в исследованиях мигрени и выявить редкие моногенные нарушения, связанные с мигренью с аурой ( панель 2 ). Эти расстройства включают семейную гемиплегическую мигрень, церебральную аутосомно-доминантную артериопатию с подкорковыми инфарктами и лейкоэнцефалопатией, васкулопатию сетчатки с церебральной лейкоэнцефалопатией и системными проявлениями и семейный синдром продвинутой фазы сна.14 Кроме того, продолжаются согласованные усилия по выделению дополнительных генов в качестве биомаркеров для других редких моногенных подтипов мигрени.14 Однако по-прежнему сложно идентифицировать причинные гены в общих полигенных подтипах и определить механизмы, которые увеличивают риск мигрени.
Генетика при мигрени
На основании исследований с близнецами наследственность мигрени оценивается в 42%.2
Полногеномный метаанализ ассоциации выявил 38 геномных локусов, которые влияют на риск мигрени.
Относительный риск мигрени без ауры составляет 1,9 у родственников первой степени родства пробандов с мигренью без ауры.
Относительный риск мигрени с аурой составляет 3,8 у родственников первой степени родства пробандов с мигренью с аурой.
Генетические биомаркеры моногенных подтипов мигрени или синдромов, связанных с мигренью
Семейная гемиплегическая мигрень
Тип 1 ( ген CACNA1A )
Тип 2 ( ген ATP1A2 )
Тип 3 ( ген SCN1A )
Церебральная аутосомно-доминантная артериопатия с подкорковыми инфарктами и лейкоэнцефалопатией ( ген NOTCH3 )
Васкулопатия сетчатки с церебральной лейкоэнцефалопатией и системными проявлениями ( ген TREX1 )
Семейный синдром продвинутой фазы сна ( ген CSNK1D )
Проблемы мигрени и перспективы на будущее
Комбинация нескольких генетических вариантов с небольшими размерами эффекта и факторами окружающей среды затруднила картирование генетических биомаркеров для распространенных подтипов мигрени. Следовательно, будущие исследования, вероятно, будут сосредоточены на изучении связи между клиническими особенностями и возможными генетическими биомаркерами. Кроме того, выявление генетических факторов риска может способствовать развитию подходов точной медицины к индивидуальным стратегиям лечения. Одно испытательное исследование, опубликованное в 2019 году, обнаружило связь между высокой полигенной нагрузкой и улучшенной реакцией на триптаны у людей с мигренью.19Это исследование является первым шагом в разработке стратегий лечения мигрени, основанных на генетике, в эпоху точной медицины. Для дальнейшего изучения возможностей фармакогенетики необходимы крупномасштабные проспективные исследования.
Прогресс, достигнутый в генетических исследованиях, позволил идентифицировать около 40 локусов, которые независимо вносят вклад в биологические основы мигрени.10Следовательно, генетический вклад является полигенным для распространенных типов мигрени, причем каждый идентифицированный вариант риска, вероятно, будет иметь лишь умеренные эффекты. Однако эти варианты риска предлагают новые идеи, которые должны улучшить наше понимание сигнальных путей, лежащих в основе патогенеза мигрени, и позволить идентифицировать основанные на механизмах мишени для лекарств.
Менделирующая рандомизация — это новый подход, в котором генетические варианты используются для определения того, согласуется ли наблюдаемая ассоциация между фактором риска и результатом с причинным эффектом.20Преимущества менделевской рандомизации включают теоретическое случайное распределение генетических вариантов, поскольку генотипы передаются случайным образом через мейоз. Хотя менделевская рандомизация является многообещающей, она требует надежной связи генетического варианта с фактором риска. Кроме того, менделевская рандомизация основана на предположении, что генетический вариант не влияет на результат через механизм, не зависящий от рассматриваемого фактора риска, и не влияет на независимые факторы, которые затрудняют взаимосвязь между фактором риска и исходом. Таким образом, данные следует интерпретировать с осторожностью, поскольку в исследованиях мигрени появляется менделевская рандомизация.
Биомаркеры провокации мигрени
Патогенез мигрени многогранен, со сложным взаимодействием между различными молекулярными сигнальными путями.5Ключевой особенностью мигрени является то, что было показано, что различные триггерные факторы вызывают приступы мигрени ( рисунок 1 ). Эта особенность предоставляет уникальную возможность идентифицировать сигнальные пути, которые вызывают мигрень, с помощью моделей провокации человека, в которых эндогенные сигнальные молекулы или другие предполагаемые триггеры используются для индукции мигрени у людей.21 год Важное наблюдение, сделанное в ходе исследований с участием людей, заключается в том, что только у людей с мигренью возникают спровоцированные приступы мигрени, в то время как у здоровых добровольцев развивается в лучшем случае легкая головная боль.21 год
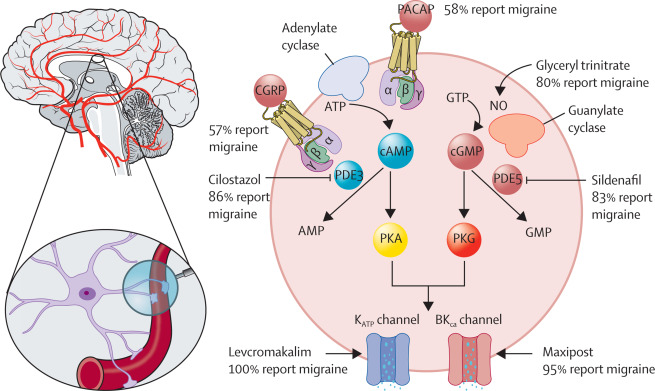
Рисунок 1 Молекулярные сигнальные пути при мигрени
Клетка — это клетка гладкой мускулатуры сосудов. Молекулярные сигнальные пути, лежащие в основе патогенеза мигрени, были изучены с использованием моделей провокации, в которых предполагаемые триггерные молекулы используются для индукции приступов мигрени у людей. Эти триггерные молекулы включают CGRP, PACAP, тринитрат глицерина, цилостазол (ингибитор PDE3), силденафил (ингибитор PDE5) и левкромакалим (открыватель K- АТФ- каналов). цАМФ = циклический аденозинмонофосфат. цГМФ = циклический гуанозинмонофосфат. CGRP = пептид, родственный гену кальцитонина. K АТФ = чувствительный к аденозинтрифосфату калий. PACAP = полипептид, активирующий аденилатциклазу гипофиза. PDE3 = фосфодиэстераза 3. PDE5 = фосфодиэстераза 5. PKA = протеинкиназа A. PKG = протеинкиназа G.
В принципе, в моделях провокации человека применяется двойной слепой перекрестный дизайн, при котором люди с мигренью или здоровые добровольцы случайным образом распределяются для приема предполагаемой триггерной молекулы или плацебо.21 год Дневник головной боли используется для записи возникновения, характеристик и сопутствующих симптомов головной боли.21 годПримечательно, что спровоцированные приступы мигрени должны соответствовать как минимум одной из двух категорий. Категория 1 описывает головную боль, по крайней мере, с двумя из следующих клинических признаков: одностороннее расположение, качество пульсации, интенсивность боли от умеренной до сильной, а также обострение или отказ от обычной физической активности. Кроме того, головная боль должна сопровождаться хотя бы одним из следующих симптомов: тошнотой, рвотой или светобоязнью и фонофобией. Категория 2 описывает головную боль, которая имитирует обычные приступы мигрени пациента и лечится с помощью спасательных препаратов.
В 1993 году первое исследование провокации мигрени показало, что у людей с мигренью после внутривенного введения донора оксида азота, тринитрата глицерина, развивается более сильная головная боль, чем у здоровых добровольцев.22С тех пор различные предполагаемые триггерные молекулы были протестированы на их способность вызывать мигрень, включая пептид, связанный с геном кальцитонина (CGRP), полипептид, активирующий аденилатциклазу гипофиза (PACAP), аденозинтрифосфат-чувствительный калиевый (K- АТФ ) открыватель каналов, и открыватель калиевых каналов с высокой проводимостью, активируемый кальцием (ВК Са ).
Внутривенное вливание CGRP или PACAP вызывает приступы мигрени примерно у 60% людей с мигренью. Более высокие показатели индукции (≥80%) наблюдались после введения тринитрата глицерина и ингибиторов фосфодиэстеразы 3 и 5 Общим фактором для всех триггерных молекул является то, что они опосредуют свои внутриклеточные эффекты через системы вторичных мессенджеров либо циклического аденозинмонофосфата (цАМФ), либо циклического гуанозинмонофосфата (цГМФ).21 год На основании этих результатов было выдвинуто предположение, что последующие эффекты передачи сигналов цАМФ и цГМФ могут включать модуляцию ионных каналов, в основном калиевых каналов.22Впоследствии было показано, что введение агента, открывающего К- АТФ- каналы, приводило к 100% -ной индукции мигрени у лиц с мигренью, тогда как соответствующая скорость индукции составляла 95% после введения открывателя ВК- Са- каналов ( рис. 1 ). Также было обнаружено, что введение агента, открывающего К- АТФ- канал, вызывает мигрень у 10 (59%) из 17 пациентов с мигренью с аурой.29 Фундаментальный вопрос, поднятый этими провокационными исследованиями, относится к месту действия, причем некоторые сторонники поддерживают периферическое происхождение мигрени, тогда как другие утверждают, что центральное происхождение более вероятно.
Проблемы и перспективы на будущее
Модели провокации человека позволили понять сигнальные пути, лежащие в основе патогенеза мигрени. Эти исследования также способствовали идентификации и разработке лекарств, нацеленных на определенные триггерные молекулы. Этот вклад наиболее очевиден в случае недавно (2018–2020 гг.) Одобренных препаратов, направленных на CGRP или его рецептор, которые доказали свою эффективность при остром и профилактическом лечении мигрени. Следовательно, будущая разработка лекарств должна частично основываться на открытиях, сделанных в исследованиях провокации людей. С этой точки зрения двумя потенциальными мишенями для лекарств являются блокаторы К- АТФ- каналов и ВК- Са- каналы, поскольку открытие этих каналов спровоцировало приступы мигрени почти у всех участников исследования с мигренью. Однако у моделей провокации со стороны человека есть и ограничения. Например, селективное ингибирование синтазы оксида азота (NOS) было предложено в качестве возможной лекарственной мишени для лечения мигрени на основании двух ключевых фактов: тринитрат глицерина вызывает приступы мигрени, а введение неселективного ингибитора NOS привело к облегчению головной боли у людей с мигренью. Однако ингибирование индуцируемого оксида азота не прекращало и не предотвращало приступы мигрени.
Помимо открытия лекарств-мишеней для мигрени, модели провокации человека также могут использоваться в качестве биомаркера для прогнозирования эффективности основанных на механизмах методов лечения, таких как блокаторы передачи сигналов CGRP.21 годНеобходимы крупномасштабные регистрационные исследования, в которых людей с мигренью сначала провоцируют внутривенной инфузией CGRP, а затем назначают для лечения блокатором передачи сигналов CGRP, таким как моноклональные антитела против CGRP или его рецептора. Гипотеза состоит в том, что люди с мигренью, у которых развиваются спровоцированные приступы мигрени после инфузии CGRP, получат больше пользы от лечения такими препаратами, чем те, у кого не развились спровоцированные приступы после инфузии CGRP. Это обоснование остается спекулятивным, и необходимы тщательные исследования, чтобы установить, можно ли использовать модели провокации человека для прогнозирования реакции на лечение у людей с мигренью.
Биомаркеры крови
Исследования биомаркеров мигрени в крови привлекают внимание в течение последних 10 лет.4Этот интерес подогревается концепцией, что биомаркеры крови способствуют пониманию молекулярных механизмов, лежащих в основе мигрени. Были предприняты попытки установить биомаркеры крови, которые могли бы прогнозировать и контролировать реакцию на лечение у отдельных пациентов. Исследования биомаркеров крови исследовали множество циркулирующих сигнальных молекул, участвующих в патогенезе мигрени. Здесь мы сосредоточим наше обсуждение только на исследованиях биомаркеров крови CGRP и PACAP.
Иктальная фаза
В 1990 г. было проведено первое исследование концентрации CGRP в плазме внешней яремной вены во время приступов спонтанной мигрени.34Это исследование показало, что концентрации CGRP в плазме были повышены у людей с мигренью по сравнению с контрольной популяцией. Впоследствии в другом исследовании сообщалось, что иктальные (то есть во время приступов мигрени) плазменные концентрации CGRP также были повышены в периферической крови.35 год Однако эти результаты не были воспроизведены в исследовании, в котором оценивались концентрации CGRP в плазме как в наружной яремной вене, так и в периферической крови с использованием двух различных анализов. Что касается иктальных изменений PACAP, два исследования сообщили о повышенной PACAP-подобной иммунореактивности во время спонтанных приступов мигрени.
Межприступная фаза
Измерения биомаркеров крови проводились в межприступной фазе (то есть между приступами мигрени) у лиц как с эпизодической, так и с хронической мигренью. Доступные данные очень противоречивы и приводят к совершенно разным результатам. В двух исследованиях сообщалось о повышенных межприступных концентрациях CGRP в плазме крови у людей с эпизодической и хронической мигренью по сравнению со здоровыми участниками. Однако эти результаты не были воспроизведены другим исследованием, которое не обнаружило различий в концентрациях CGRP в сыворотке между людьми с хронической мигренью, людьми с эпизодической мигренью и здоровыми участниками. Что касается PACAP, то два исследования не обнаружили увеличения интерктальной фазы мигрени.
Прогнозирование ответа на лечение
В двух исследованиях сообщалось о более высоких исходных концентрациях CGRP у лиц с мигренью, которые впоследствии получали пользу от профилактического лечения онаботулинтоксином А, по сравнению с теми, кто не сообщил о терапевтическом эффекте.Однако этот результат не был воспроизведен в другом исследовании. Таким образом, остается неизвестным, могут ли измерения биомаркеров крови надежно предсказать ответ на лечение у людей с мигренью.
Проблемы и перспективы на будущее
Исследования биомаркеров мигрени в крови все еще находятся в зачаточном состоянии, и многое еще предстоит сделать. Несогласованные результаты могут быть объяснены методологическими ограничениями, небольшими размерами выборки и различиями в дизайне исследований и анализах. Следовательно, необходимы дальнейшие исследования для оптимизации точности и воспроизводимости данных. Отсутствие стандартизированных методов сбора данных и обработки образцов затрудняет сравнение исследований. Например, анализы, используемые в исследованиях CGRP, чрезвычайно разнообразны и недостаточно проверены. Недостаточная валидация анализа приводит к невозможности уверенно определить, выявляет ли анализ только интересующий биомаркер крови. Например, анализы ELISA используются для обнаружения CGRP и PACAP, но эти анализы также могут обнаруживать близких родственников. В большинстве анализов (например, радиоиммуноанализ или ELISA) для обнаружения пептидов используются антитела, но антитела часто могут обнаруживать как пептидные фрагменты, так и интактный пептид. Следовательно, важно описывать результаты как CGRP-подобную и PACAP-подобную иммунореактивность. Каждый анализ должен быть изначально подтвержден посредством строгого процесса, который учитывает чувствительность, специфичность, вариабельность между анализами и внутри анализа, а также влияние матричной интерференции (например, сыворотки или плазмы). Существует множество аспектов обработки образцов, которые могут повлиять на результаты, такие как использование плазмы или сыворотки, временные задержки, присутствие ингибиторов протеазы (которые могут влиять на анализы), состав пробирок для хранения и циклы замораживания-оттаивания. Все образцы также должны попадать в линейный диапазон анализа. Исследователи должны следовать соответствующим руководящим документам (например,Подтверждение биоаналитического метода Управлением по санитарному надзору за качеством пищевых продуктов и медикаментов США) и должным образом сообщить о своих методах. Коммерчески доступные анализы нечасто имеют достаточную валидацию, чтобы дать уверенность в результатах. Помимо валидации анализа, также необходимы исследования с большими образцами и соответствующими контрольными группами. В будущих исследованиях следует рассмотреть возможность перехода от подходов с использованием одного биомаркера к панели с несколькими биомаркерами. Такой подход может показать улучшенное разделение между группами и дать воспроизводимые данные, необходимые для проверки биомаркеров мигрени на основе крови.
Визуальные биомаркеры
В исследованиях биомаркеров мигрени МРТ стала полезной технологией для выявления структурных и функциональных изменений у людей с мигренью. Изменения функциональной связности были исследованы как в интериктальной, так и в иктальной фазе приступа мигрени.46
Структурная визуализация
Многочисленные МРТ-исследования изучали различия в структуре мозга людей с мигренью и здоровых людей из контрольной группы, а также различия между мигренью с аурой и без нее. Гиперинтенсивность белого вещества широко изучалась, но с противоречивыми результатами. Примечательно, что опубликованный в 2013 году метаанализ популяционных исследований выявил связь гиперинтенсивности белого вещества с мигренью с аурой, но не мигренью без ауры, по сравнению с контрольной группой. Кроме того, при прямом сравнении мигрени с аурой и мигрени без ауры не было никакой разницы в показателях гиперинтенсивности белого вещества. Популяционное МРТ-исследование, опубликованное в 2016 году, не обнаружило связи между гиперинтенсивностью белого вещества и мигренью с аурой.
В других исследованиях МРТ оценивались различия в параметрах коры головного мозга (например, толщина, объем, площадь поверхности) и целостности тракта белого вещества. Например, в одном популяционном МРТ-исследовании оценивались различия в толщине коркового слоя у женщин с мигренью с аурой по сравнению с контрольной популяцией женщин без мигрени и было обнаружено, что более толстая кора головного мозга соответствует визуальным областям в группе мигрени.49 Кроме того, одно исследование с визуализацией тензора диффузии обнаружило структурные изменения в восходящих (например, тригеминоталамический тракт или таламокортикальный тракт) и нисходящих болевых путях (например, периакведуктальный серый), которые могут соответствовать таламическим изменениям, о которых сообщалось в одном многоцентровом исследовании. Результаты этих и других МРТ-исследований важны, поскольку структурная визуализация может использоваться для подтверждения или дополнения диагностики мигрени у пациентов, которых трудно классифицировать только на основании их клинических симптомов. Эта тема была исследована в исследовании, посвященном проверке правильности концепции,52в котором авторы использовали корковые классификаторы (например, толщину, объем или площадь поверхности), чтобы определить, имел ли человек эпизодическую мигрень, хроническую мигрень или был здоровым человеком. Корковые классификаторы были довольно точными для хронической мигрени по сравнению со здоровой контрольной группой с точностью классификатора 86,3%. Более крупные образцы (по сравнению с существующими исследованиями) и новые достижения в технологиях визуализации, несомненно, продолжат изучение потенциала и осуществимости моделей диагностической классификации на основе структурной визуализации. Примечательно, что некоторые исследования обнаружили различия в структуре мозга при сравнении людей с мигренью и людьми с другими расстройствами головной боли, такими как головная боль напряжения и головная боль, связанная с черепно-мозговой травмой.
Функциональная визуализация
Исследования функциональной МРТ (фМРТ) показали, что мигрень связана с изменениями функциональной связи и вызванной стимулом активацией мозговых цепей, связанных с зонами обработки боли и зрительными системами. Кроме того, комбинированное исследование позитронно-эмиссионной томографии и МРТ, опубликованное в 2019 году, показало активацию глии в областях обработки боли при мигрени у пациентов с аурой по сравнению со здоровыми людьми из контрольной группы. Все большее количество исследований фМРТ также начали оценивать использование данных интериктальной функциональной связности для разработки визуализирующих биомаркеров для различных целей, таких как диагностическая классификация мигрени и прогнозирование частоты приступов мигрени. Подобно структурной визуализации, эти модели биомаркеров функциональной визуализации требуют дальнейшей доработки и проверки в многоцентровых условиях.
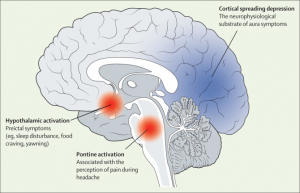
Преиктальная фаза начинается за 48 ч до начала мигрени. Это проявляется клиническими признаками (например, нарушениями сна, тягой к пище), которые связаны с активацией гипоталамуса как при спонтанных, так и при спонтанных приступах мигрени, вызванных тринитратом глицерина, по данным фМРТ. Что касается фазы ауры мигрени, визуальные исследования показали функциональные изменения, согласующиеся с кортикальной распространяющейся депрессией, которая, как широко считается, является основной нейрофизиологической причиной субстрата.
Исследования функциональной визуализации показали повышенную активность спинного моста во время фазы головной боли при спонтанных приступах мигрени.69, 70Этот результат был также воспроизведен после приступов мигрени, вызванных тринитратом глицерина, при которых активация дорсального моста была ипсилатеральной у пациентов с односторонними приступами мигрени и двусторонней у пациентов с двусторонними приступами мигрени ( рис. 2 ). В совокупности эти данные привели к выводу, что активация дорсального моста, вероятно, является визуализирующим биомаркером фазы головной боли при мигрени. Примечательно, что повышенная функциональная связь также была показана между мостом и соматосенсорной корой во время приступов мигрени с аурой.
Рисунок 2 Функциональные церебральные изменения в головном мозге, страдающем мигренью.
Проблемы и перспективы на будущее
Структурные и функциональные исследования с визуализацией предоставили ключевые сведения о патогенезе мигрени и заложили основу для разработки биомаркеров на основе визуализации. Дальнейшие исследования должны быть сосредоточены на уточнении биомаркеров визуализации, повышении их точности, определении их чувствительности и специфичности и, в конечном итоге, их валидации для клинического использования. Для этого следует внедрить стандартизированные протоколы визуализации, чтобы обеспечить получение высококачественных данных и возможность проведения сравнительных оценок. Чтобы получить дополнительную патофизиологическую информацию, необходимы крупномасштабные визуализационные исследования для оценки структурных и функциональных различий между различными расстройствами головной боли с частично совпадающими клиническими признаками. Кроме того, в будущих исследованиях визуализации также следует выяснить, можно ли использовать методы визуализации для прогнозирования реакции на лечение. Важное соображение при исследованиях фМРТ должно включать использование анализа на основе данных и подтверждение результатов независимой исследовательской группой. Это соображение позволит получить более надежные результаты и повысить вероятность воспроизводимости. В ожидании таких визуализационных исследований мы должны продолжать поощрять более инновационные подходы к определению визуализационных биомаркеров мигрени.
Интеграция модальностей биомаркеров
Интеграция модальностей биомаркеров предлагает многообещающий способ объединить данные из нескольких источников и определить новые биомаркеры мигрени. Кроме того, такие подходы могут способствовать нашему пониманию механизмов заболевания, лежащих в основе мигрени, и в нескольких исследованиях была предпринята попытка объединить методы биомаркера и установить стратегическое междисциплинарное сотрудничество в исследованиях. Здесь мы суммируем результаты исследований, в которых использовались по крайней мере два из четырех методов биомаркера.
Комбинация генетических и провокационных биомаркеров была использована для исследования эффектов CGRP у людей с семейной гемиплегической мигренью. CGRP не вызывал приступов мигрени у пациентов с семейной гемиплегической мигренью, у которых были известны мутации ионных каналов, и у тех, у кого этого не было. Этот вывод контрастирует с результатами, полученными при распространенных типах мигрени.Кроме того, другое провокационное исследование не выявило связи между высокой семейной нагрузкой (≥2 родственников первой степени родства с мигренью) и скоростью индукции мигрени после инфузии PACAP у лиц с мигренью без ауры.
Другая комбинация методов включает нейровизуализацию и модели провокации человека. В трех исследованиях использовалась магнитно-резонансная ангиография (МРА) для регистрации сосудистых изменений после спровоцированных приступов мигрени у людей с мигренью без ауры. Первое исследование MRA показало, что приступы мигрени, вызванные CGRP, сопровождались расширением как средней мозговой артерии (MCA), так и средней менингеальной артерии (MMA). Расширение СМА и ММА присутствовало только на стороне боли у тех, у кого развились односторонние приступы мигрени.76 В другом исследовании MRA изменения MCA и MMA были зарегистрированы после индукции мигрени с использованием ингибитора фосфодиэстеразыАвторы сообщили, что спровоцированные приступы были связаны с расширением ММА со стороны боли, но не с расширением СМА. Кроме того, одно исследование MRA показало, что приступы мигрени, вызванные PACAP, были связаны с дилатацией MMA, но не с расширением MCA;78 авторы не обнаружили связи между спровоцированными приступами и локализацией боли.
Модели нейровизуализации и провокации также были объединены для изучения изменений функциональной связи до и в начале спровоцированных приступов мигрени. В одном рандомизированном двойном слепом исследовании с помощью фМРТ в состоянии покоя аномальная функциональная связность была обнаружена во всех исследованных церебральных сетях (сенсомоторной, заметной и по умолчанию) после внутривенной инфузии PACAP.79После внутривенной инфузии вазоактивного кишечного пептида (активное плацебо) изменений функциональной связности обнаружено не было. Все исследованные мозговые сети ранее участвовали в обработке ноцицепции и эмоций.80, 81 год
Выводы
Исследования биомаркеров уже внесли большой вклад в наше понимание патогенеза мигрени. Достижения в области генетики, моделей провокации, биохимии и нейровизуализации показали потенциал подходов, основанных на биомаркерах, к диагностике, лечению и открытию лекарств. Усилия по объединению модальностей биомаркеров улучшили понимание биологической сложности, лежащей в основе мигрени и ее подтипов. Основываясь на этом фундаменте, будущие исследования должны изучить подходы точной медицины, улучшающие диагностику и лечение мигрени.