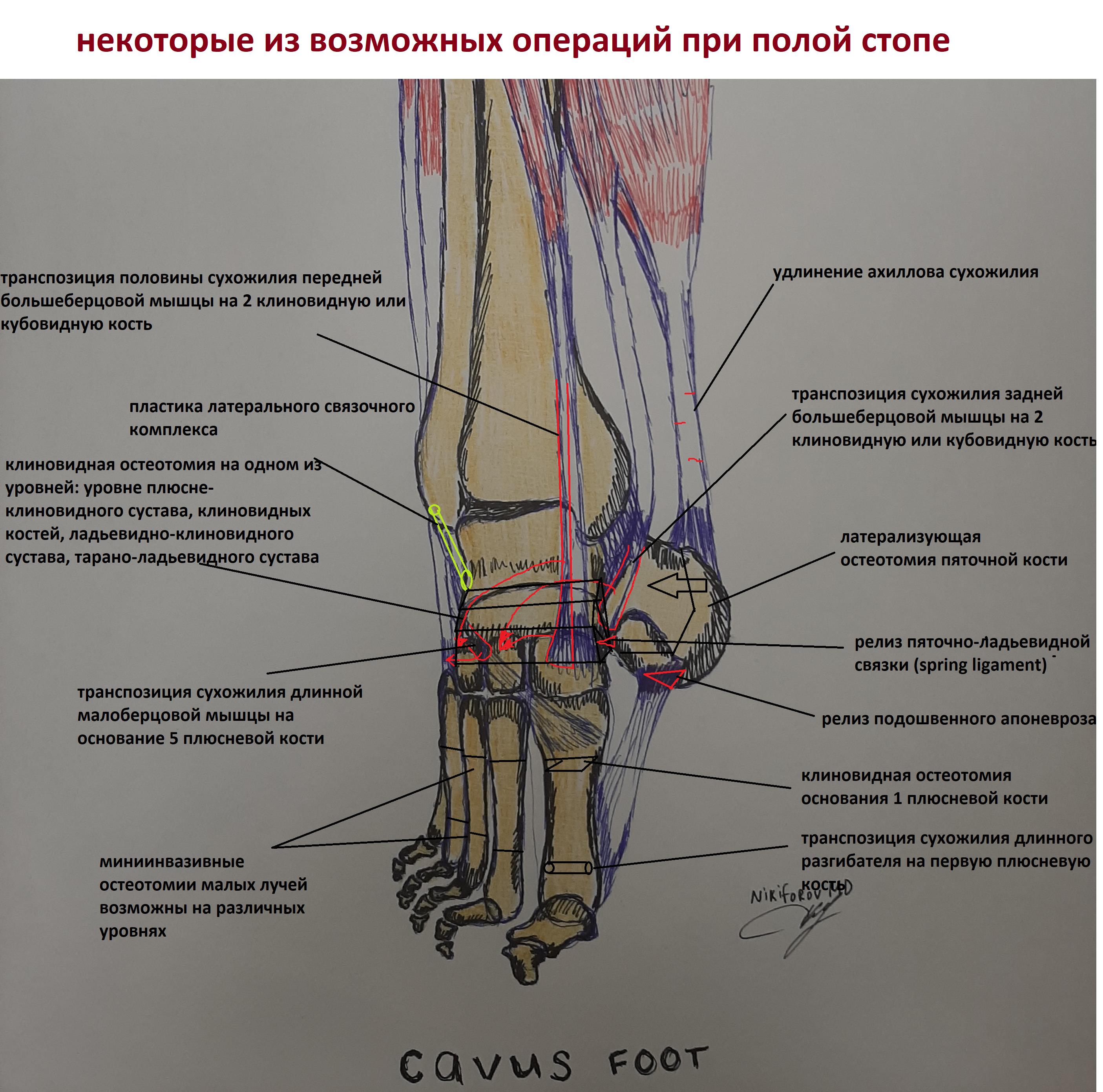
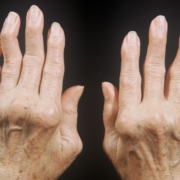
Рентгенологическое исследование ревматоидный артрит остается золотым стандартом инструментальной диагностики наиболее распространенных иммуновоспалительных ревматических заболеваний – ревматоидного артрита (РА) и анкилозирующего спондилита (АС).
В статье рассматриваются показания и методические аспекты проведения стандартной рентгенографии опорно-двигательного аппарата при РА и АС. Описаны также основная радиологическая симптоматика, методы оценки стадийности патологий по O. Steinbrocker и J. Kellgren, а также рентгенологического прогрессирования по J.T. Sharp/D.M. van der Heijde и A. Larsen при РА, по mSASSS, RASSS, BASRI при АС.
Ревматоидный артрит. Таблицы и рентгенограммы

Таблица 1. Дифференциальная диагностика рентгенологических изменений в кистях и стопах при остеоартрите, псориатическом артрите и ревматоидном артрите
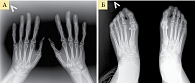
Рис. 1. Рентгенограмма кистей (А) и стоп (Б) при РА первой стадии (по методу O. Steinbrocker)
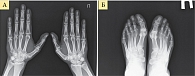
Рис. 2. Рентгенограмма кистей (А) и стоп (Б) при РА второй стадии (по методу O. Steinbrocker)
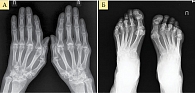
Рис. 3. Рентгенограмма кистей (А) и стоп (Б) при РА третьей стадии (по методу O. Steinbrocker)
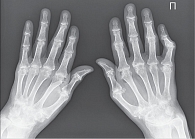
Рис. 4. Рентгенограмма кистей при РА четвертой стадии (по методу O. Steinbrocker)
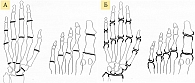
Рис. 5. Суставы, в которых оценивается сужение суставных щелей (0–4) (А), и суставы, в которых оцениваются эрозии (0–4) (Б) (по методу Sharp/van der Heijde)
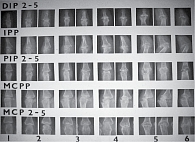
Рис. 6. Пример стандарта рентгенограмм по методу А. Larsen
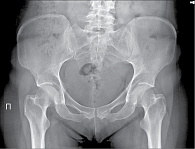
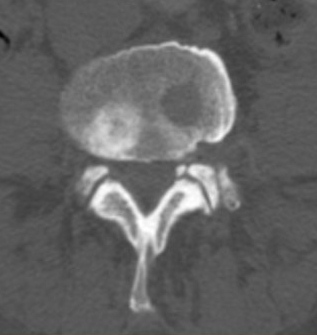
Рис. 7. Рентгенограмма таза при сакроилиите первой стадии
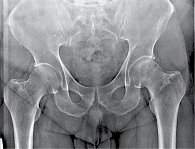
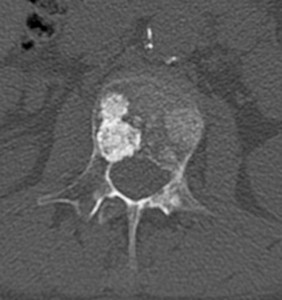
Рис. 8. Рентгенограмма таза при сакроилиите второй стадии
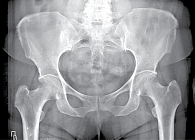
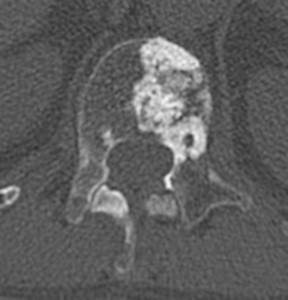
Рис. 9. Рентгенограмма таза при сакроилиите третьей стадии
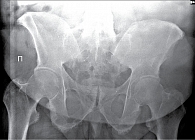
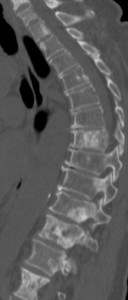
Рис. 10. Рентгенограмма таза при сакроилиите четвертой стадии

Таблица 2. Сравнительная характеристика рентгенологических методов оценки изменений в позвоночнике при анкилозирующем спондилите
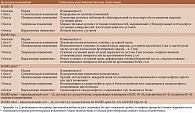
Таблица 3. Градация изменений по BASRI и их описание
Иммуновоспалительные ревматические заболевания (ИВРЗ) представляют собой довольно крупную и разнородную по проявлениям группу болезней, ключевыми механизмами развития которых признаны аутоиммунитет и хроническое воспаление. Для ИВРЗ характерны прогредиентное течение и поражение как опорно-двигательного аппарата, так и других органов и систем. Кроме того, в целом они относятся к категории наиболее тяжелых видов патологии человека.
Современная терапия генно-инженерными биологическими и таргетными синтетическими препаратами способна эффективно подавлять иммунное воспаление, вызывать длительную ремиссию и тормозить развитие функциональных нарушений, сохраняя трудоспособность пациентов. Однако она является весьма дорогостоящей и требует тщательного контроля безопасности.
В рамках стратегии лечения до достижения цели (Treat to Target) [1] важнейшими компонентами являются ранняя агрессивная терапия, которая также предусматривает раннюю диагностику, и оценка ответа на нее. Это в свою очередь предполагает использование комплекса методов обследования, среди которых далеко не последнее место занимают инструментальные методы.
Первым методом лучевой диагностики опорно-двигательного аппарата было рентгенологическое исследование. Другие виды лучевой диагностики, такие как компьютерная и магнитно-резонансная томография, применяются в качестве дополнительных.
В настоящее время наиболее доступным и распространенным методом исследования ревматических заболеваний является рентгенография кистей, стоп, осевого скелета и костей таза. Цифровая рентгенография в отличие от классической ассоциируется с меньшей дозой радиационной нагрузки на пациента. Однако врачи нередко забывают об этой неотъемлемой составляющей исследования костно-суставной системы.
Рентгенологическое исследование позволяет определить стадию заболевания, а при динамическом контроле – эффективность проводимой терапии, прогноз, возможность применения современных методов лечения.
При рентгенологическом исследовании необходимо строго выполнять требования к укладке пациентов, выбирать оптимальные физико-технические параметры съемки, в ряде случаев предварительно готовить больных к процедуре.
Среди ИВРЗ особое место занимают ревматоидный артрит (РА) и анкилозирующий спондилит (АС) в силу широкой распространенности и тяжелого течения. Нередко данные заболевания поражают лиц молодого возраста и могут приводить к ранней инвалидизации (в течение пяти лет от появления симптомов) и смерти [2].
Особенности рентгенологической симптоматики на разных стадиях РА и АС определяют значимость краткого описания методов лучевой диагностики.
Ревматоидный артрит (коды по МКБ-10 – М05, М06)
Ревматоидный артрит – хроническое иммуновоспалительное заболевание, основным проявлением которого является деструктивный (эрозивный) артрит, поражающий синовиальные суставы, часто сопровождающийся внесуставными (системными) проявлениями [2].
Для РА характерны упорное прогрессирование, а также широкий спектр вариантов дебюта, течения, осложнений и исходов. Отсутствие активного лечения приводит к тяжелой инвалидизации, а также преждевременной смерти из-за осложнений или развития коморбидной патологии.
Таким образом, РА приобретает серьезное общемедицинское значение [3].
Системное воспаление при РА обусловлено гиперпродукцией провоспалительных цитокинов, таких как интерлейкин 6 и фактор некроза опухоли α, для которых свойственна плейотропность воздействия на организм.
Гиперпродукция провоспалительных цитокинов приводит к активации клеток синовиальной оболочки суставов, фибробластов подлежащей соединительной ткани и эндотелия сосудов, сопровождающейся их пролиферацией. В результате фибробластоподобные синовиоциты приобретают агрессивный воспалительный фенотип, активируются процессы неоангиогенеза, что приводит к активному формированию в суставе грануляционной ткани – паннуса, опухолевидно разрастающегося и разрушающего хрящ и подлежащую кость [4–6].
Кроме того, под влиянием провоспалительных цитокинов, в частности интерлейкина 6 и фактора некроза опухоли α, баланс процессов костеобразования и разрушения нарушается и развивается остеопороз. Иммунокомпетентные клетки способны продуцировать RANKL, активатор остеокластов, остеопротегерин, рецептор-ловушку для RANKL, а также участника остеокластогенеза [7–9].
Таким образом, у пациентов с активным РА имеют место повышенная резорбция кости и локальная потеря костной массы. Кроме того, они подвержены повышенному риску генерализованной потери костной массы, вертебральных и невертебральных переломов [10].
Вследствие указанных выше патогенетических процессов развивается деструктивный процесс в суставах, наиболее рано и очевидно выявляемый в суставах кистей и стоп.
Основные изменения, выявляемые на стандартных рентгенограммах
Стандартным (обязательным) рентгенологическим исследованием при РА является рентгенография кистей (включая кости запястья и лучезапястные суставы) и дистальных отделов стоп в прямой проекции. Рентгенография кистей и стоп в боковой и других проекциях в большинстве случаев не дает дополнительной информации для рентгенодиагностики, поэтому не рекомендуется для рутинной практики. Рентгенография крупных и мелких суставов других локализаций проводится при подозрении на выраженную, имеющую клиническое значение деструкцию либо другую, не связанную с РА патологию (например, остеоартрит), а также при необходимости охарактеризовать повреждение суставов перед ортезированием либо ортопедо-хирургическим лечением.
Среди характерных структурных повреждений при РА отмечают локальный (околосуставной) остеопороз, сужение суставной щели, локальное повреждение кости в пределах анатомических границ сустава (эрозии, или узуры). Исходом воспаления является полное разрушение суставного хряща с формированием костного анкилоза.
Рентгенологическим признаком данного заболевания служит развитие хронического артрита с множественной локализацией и прогрессированием процесса. После короткого рентген-негативного периода на рентгенограммах определяются повышенная прозрачность и кистовидные просветления костной ткани в области пораженных суставов. При прогрессировании отмечаются сужение суставных щелей, эрозии суставных поверхностей костей, подвывихи и вывихи в суставах. Скорость указанных процессов у разных пациентов различна.
Для РА наиболее типично поражение кисти: проксимальных межфаланговых, пястно-фаланговых, запястно-пястных, межзапястных и лучезапястных суставов (последние традиционно относят к мелким суставам). Исключением является первый запястно-пястный сустав, который наиболее часто поражается при остеоартрите/остеоартрозе (ОА).
В течение нескольких десятилетий характерные рентгенологические изменения входили в диагностические/классификационные критерии РА, пока не стало очевидным, что типичный эрозивный процесс развивается относительно поздно. Так, согласно результатам нашего многолетнего исследования, на первом году болезни у 71,7% из 238 пациентов с РА отмечался неэрозивный артрит по данным рентгенографии. Эрозии мелких суставов, включая кисти и стопы, выявлялись в среднем через 3,8 года от начала болезни [11]. Именно поэтому рентгенологическое исследование стало рассматриваться как низкочувствительное на ранней стадии и не было включено в современные классификационные критерии РА [12].
Тем не менее стандартная рентгенография кистей и стоп является необходимой на этапе первичного обследования при подозрении на РА. Во-первых, у некоторых пациентов рентгенологические изменения могут обнаруживаться уже на ранней стадии болезни. В этом случае они подтверждают диагноз. Наличие эрозивного процесса может быть значимо для дифференциальной диагностики, в частности в случае недифференцированного артрита. Рентгенологические изменения также являются важными на этапе поздней диагностики, когда классификационные критерии Американской коллегии ревматологов и Европейской антиревматической лиги 2010 г. могут работать некорректно [12]. Во-вторых, выявление эрозий на ранней стадии РА считается признаком неблагоприятного прогноза и показанием к назначению более агрессивной терапии [13].
Оценка динамики рентгенологических изменений важна для установления эффективности проводимой терапии. В этом случае необходимы исходные рентгенограммы.
Рентгенография суставов при РА используется:
- для выявления ранних структурных повреждений суставов, которые позволяют уточнить диагноз в тех случаях, когда классификационные критерии не позволяют поставить достоверный диагноз РА;
- характеристики РА на продвинутой стадии, когда активность воспалительного процесса может быть низкой и преобладают признаки деструкции и анкилоза суставов;
- определения характера прогрессирования деструкции суставов для оценки прогноза и эффективности терапии базисными препаратами;
- характеристики повреждений суставов перед ортезированием и ортопедо-хирургическим лечением.
Рентгенографию кистей и стоп рекомендуется проводить при установлении диагноза и далее каждые 12 месяцев всем пациентам с развернутой стадией РА с целью оценки прогрессирования деструкции суставов.
Необходимо строго соблюдать методику выполнения рентгенографии обследуемых анатомических областей.
Протоколы рентгенологических исследований кистей и стоп
В настоящее время приняты следующие протоколы рентгенологических исследований при РА [14].
Кисти (прямая ладонная (передняя) проекция). Назначение рентгенографии: все случаи заболеваний костей и суставов кисти, изучение и оценка скелета кисти в целом, включая лучезапястный сустав, запястье, пястье и фаланги пальцев.
Укладка: освободить руки пациента от украшений, исследуемого посадить лицом к краю рентгенографического стола, ноги располагаются перпендикулярно краю стола, руки – на столе, при этом они разогнуты в локтевом суставе, кисти параллельны, находятся в положении пронации, ладонь плотно прилежит к столу (для контроля прилегания кисти к столу можно положить мешочек с песком на дистальную часть предплечья), пальцы выпрямлены и сомкнуты, срединная поперечная прямая исследуемой области проецируется на головки пястных костей, половые органы экранируются просвинцованным фартуком, маркировка (правая, левая) стороны исследования.
Центральный луч рентгеновского излучения: направляют перпендикулярно столу на срединную поперечную прямую между кистями на уровне головки пястных костей.
Правильность укладки: полностью визуализируются левая и правая кисти от лучезапястных суставов до дистальных фаланг пальцев.
Информативность рентгенограммы: на снимке выявляются дистальные метаэпифизы костей предплечья, рентгеновская суставная щель лучезапястного сустава, кости запястья, пястья и фаланги пальцев, хорошо прослеживаются мелкие суставы кисти – контуры суставной поверхности и суставные щели. При правильных физико-технических параметрах рентгенограммы определяются губчатая структура костномозговой полости, компактный кортикальный слой, контуры суставных поверхностей коротких трубчатых костей пястья и фаланг, оценивается локализация повреждения – симметричность, наличие осевой локализации, патология пальцев, поражение костей запястья.
При рентгенографии кистей в прямой проекции при патологических изменениях можно выявить деструктивные (эрозивные) поражения суставных поверхностей, остеолитические изменения мелких суставов (внутрисуставной остеолиз), костную пролиферацию.
Стопы (прямая подошвенная проекция). Назначение рентгенографии: все случаи заболеваний костей и суставов стопы, изучение и оценка скелета стопы, предплюсны, плюсны и фаланг пальцев.
Укладка: пациент должен снять обувь, верхнюю одежду, носки, исследуемого следует уложить или усадить на рентгенографический стол, обе ноги должны быть согнуты в тазобедренных и коленных суставах, стопы параллельны, плотно прилежат к столу, срединная поперечная прямая исследуемой области проецируется на головку третьей плюсневой кости (уровень бугристости пятой плюсневой кости), половые органы экранируются просвинцованным фартуком, маркировка (правая, левая) стороны исследования.
Центральный луч рентгеновского излучения: направляют перпендикулярно столу на срединную поперечную прямую между стопами на уровне головки третьей плюсневой кости.
Правильность укладки: полностью визуализируются левая и правая стопы на уровне предплюсны, плюсны и фаланг пальцев.
Информативность рентгенограммы: на снимке выявляются кости предплюсны, плюсны и фаланги пальцев, хорошо прослеживаются мелкие суставы стопы, суставные поверхности и суставные щели.
При правильных физико-технических параметрах рентгенограммы определяются губчатая структура, костномозговые полости, компактный кортикальный слой, контуры суставных поверхностей коротких трубчатых костей плюсны и фаланг, оцениваются локализация повреждения, симметричность, наличие осевой локализации патологии пальцев, поражение костей предплюсны.
При рентгенографии стоп в прямой проекции при патологических изменениях можно выявлять деструктивные (эрозивные) поражения суставных поверхностей, остеолитические изменения мелких суставов (внутрисуставной остеолиз), костную пролиферацию.
Протоколы описания рентгенографии кистей и стоп
Протоколы описания рентгенографии кистей и стоп должны включать оценку:
- суставной щели – не изменена, сужена, расширена, локализация измененного сустава (или каждого сустава), симметричность или асимметричность изменений суставов, осевое поражение пальцев;
- суставных отделов поверхностей (околосуставных отделов) костей, образующих суставы, – наличие таких деструктивных изменений, как кисты, эрозии, лизис;
- околосуставных мягких тканей – наличие веретенообразного утолщения.
Каждое описание рентгенологической картины должно заканчиваться заключением с указанием предполагаемого диагноза и рентгенологической степени (стадии) процесса.
Определение стадии
Рентгенодиагностика и определение рентгенологических стадий РА проводятся на основании оценки изменений в мелких суставах кистей и дистальных отделах стоп [15, 16]. Сужение суставной щели, эрозии и другие деструктивные изменения (подвывихи, аваскулярный некроз костей, анкилозы) могут встречаться и в крупных суставах, но, как правило, на поздних стадиях [11]. Рентгенография крупных суставов (плечевого, локтевого, коленного, голеностопного, таза) не рекомендуется при РА в качестве рутинного метода и проводится только при наличии особых показаний (подозрение на остеонекроз, септический артрит, перелом, новообразования) [17].
Для РА характерно симметричное поражение суставов кистей и стоп. Чаще поражаются суставы запястья, проксимальные межфаланговые суставы. Может встречаться и поражение дистальных межфаланговых суставов, обычно на поздней стадии болезни [18]. Ранние рентгенологические признаки РА, как правило, обнаруживаются во втором и третьем пястно-фаланговых суставах, третьем проксимальном межфаланговом суставе, в суставах запястья, лучезапястном суставе, на уровне шиловидного отростка локтевых костей и в пятом плюснефаланговом суставе. Костные анкилозы чаще выявляются в межзапястных суставах, во втором – пятом запястно-пястных суставах, реже – в предплюснах. Анкилозы обычно не формируются в первых запястно-пястных, пястно-фаланговых и межфаланговых суставах кисти, плюснефаланговых суставах стоп.
К особенностям рентгенологических изменений в суставах при РА в пожилом возрасте относятся:
- частое выявление признаков остеоартрита/деформирующего остеоартроза (сужение суставных щелей, кисты) в дистальных межфаланговых суставах кистей, крупных суставах, реже в пястно-фаланговых суставах;
- наличие постменопаузального остеопороза.
В сложных случаях при несоответствии классификационным критериям нужно выявить эрозии в типичных для РА суставах – в запястье и пястно-фаланговых суставах кисти, плюснефаланговых суставах стоп.
Типичное для ревматоидного артрита эрозивное заболевание определяется как наличие на рентгенограммах обеих кистей и стоп мест разрыва кортикального слоя кости, которые должны быть визуализированы по крайней мере в трех отдельных суставах на любом из следующих участков: проксимальные межфаланговые, пястно-фаланговые суставы, суставы запястья (рассматриваются как один сустав) и плюснефаланговые суставы [19]. На основании рентгенограмм кистей и стоп помимо типичных эрозий оцениваются такие изменения, как остеопороз, кистовидные просветления костной ткани (кисты), сужение суставной щели, костные анкилозы, деформация костей, остеолиз, вывихи, подвывихи и сгибательные контрактуры суставов [16].
В таблице 1 представлены дифференциально-диагностические признаки, оцениваемые при проведении рентгенографии кистей и стоп при РА и двух других основных ревматических заболеваниях, для которых характерны суставные поражения этой локализации (остеоартрите/остеоартрозе, псориатическом артрите (ПсА)).
Множественные эрозии характерны именно для РА и нетипичны для ОА. При ОА относительно ранним признаком может быть формирование остеофитов. Для ПсА характерно сочетание эрозий и остеопролиферации. Множественные подвывихи типичны для РА. При ПсА они наблюдаются реже. При ОА преимущественно встречается поражение первого запястно-пястного сустава. Остеолиз наиболее типичен для мутилирующего варианта ПсА. У пациентов с РА он встречается значительно реже. И не характерен для ОА. Анкилоз характерен для РА (основная локализация – суставы запястья). При ПсА он наблюдается редко, при ОА – практически никогда.
В клинических рекомендациях Минздрава России 2021 г. [17] подчеркивается, что характерные рентгенологические признаки выявляются именно в кистях и стопах, а поражение остальных суставов неспецифично, поэтому развернутая оценка рентгенологических стадий дается с использованием стандартных рентгенограмм кистей и стоп по O. Steinbrocker. Классификация стадий поражения мелких суставов при РА по O. Steinbrocker [15] применяется уже более 70 лет и подразумевает четыре стадии по ведущим рентгенологическим симптомам:
- первая стадия – небольшой околосуставной остеопороз, единичные кистовидные просветления костной ткани, допускается незначительное сужение суставных щелей в отдельных суставах (рис. 1);
- вторая стадия – умеренный (выраженный) околосуставной остеопороз, множественные кистовидные просветления костной ткани, сужение суставных щелей, единичные эрозии суставных поверхностей, но не более четырех, небольшие деформации костей (рис. 2);
- третья стадия – умеренный (выраженный) околосуставной остеопороз, множественные кистовидные просветления костной ткани, сужение суставных щелей, множественные эрозии суставных поверхностей (более четырех), множественные выраженные деформации костей, подвывихи и вывихи суставов (рис. 3);
- четвертая стадия – умеренный (выраженный) околосуставной (распространенный) остеопороз, множественные кистовидные просветления костной ткани, сужение суставных щелей, множественные эрозии костей и суставных поверхностей, множественные выраженные деформации костей, подвывихи и вывихи суставов, единичные или множественные костные анкилозы, субхондральный остеосклероз, остеофиты на краях суставных поверхностей (рис. 4).
В оригинальной классификации O. Steinbrocker [15] количество эрозий не включено в перечень критериев. Оно появилось позднее в отечественных модификациях данной классификации. Введение ограничения по количеству эрозий – до четырех или пять и более – было необходимо для конкретизации понятия «множественные эрозии». По сути, количество эрозий не имеет значения в рамках определения стадий по классификации O. Steinbrocker, поскольку основная ее задача – дать общую характеристику не рентгенологических, а анатомических стадий болезни.
К сожалению, на практике можно встретить примеры абсолютизации отечественной модификации, когда третья стадия РА диагностируется на основании обнаружения пяти небольших эрозий в разных суставах в отсутствие деформации костей и подвывихов. С нашей точки зрения, это противоречит духу и смыслу классификации O. Steinbrocker, согласно которой третья стадия – это стадия тяжелых анатомических нарушений и выраженная утрата функции. В этой связи хочется подчеркнуть, что в рамках классификации O. Steinbrocker нельзя искусственно выделять какой-то один признак и на его основании делать вывод. Необходимо полное соответствие приведенным критериям.
Оценка рентгенологического прогрессирования
Классификация O. Steinbrocker – относительно грубый инструмент для оценки динамики изменений при РА. Именно поэтому для определения степени прогрессирования рентгенологических изменений в рамках клинических испытаний лекарственных препаратов были разработаны более точные методики, которые требуют больших трудозатрат рентгенолога и поэтому редко используются в клинической практике.
Рентгенологическое прогрессирование, так же как стадии РА, оценивается по стандартным рентгенограммам кистей и стоп. При РА преобладает деструкция хряща и костной ткани, сопровождающаяся потерей костной массы и проявляющаяся развитием типичных костных эрозий [20, 21]. Как было отмечено ранее, эрозивный процесс типичен для РА. Он отмечается практически у 98% больных при достаточно длительном наблюдении [22]. Прогрессирование выражается в уменьшении суставных щелей и увеличении количества эрозий, а также в появлении и усугублении подвывихов и анкилозов. Рентгенологическое прогрессирование рассматривается в качестве одного из ключевых показателей тяжести состояния [21]. Раннее возникновение эрозий признано фактором неблагоприятного прогноза [23]. Торможение рентгенологического прогрессирования – один из главных показателей базисного действия противоревматических препаратов [21].
Необходимо подчеркнуть, что рентгенография до сих пор считается важнейшим методом визуализации для оценки прогрессирования заболевания [24]. Это связано с тем, что рентгенологическое прогрессирование рассматривается в качестве показателя необратимых изменений в суставах у больных РА [22]. Несмотря на наличие случаев восстановления костной ткани на месте эрозий, в подавляющем большинстве методические аспекты таковых вызывают вопросы, связанные с индивидуальной трактовкой конкретных рентгенограмм.
Выявляемое с помощью рентгенографии структурное прогрессирование ассоциируется с ухудшением функциональных возможностей больного [25]. Структурное прогрессирование становится определяющим на поздних стадиях болезни, поскольку необратимые деструктивные повреждения накапливаются [26, 27].
При раннем РА рентгенологическая деструкция и нарушение функции суставов не коррелируют. Связь между повреждением и функциональными нарушениями становится линейной, когда показатели рентгенологического повреждения превышают 33%. При позднем РА (обычно при длительности болезни более восьми лет) отмечается сильная корреляция между повреждением и снижением функции суставов (коэффициент Пирсона – до 0,70). В целом на рентгенологическое повреждение суставов приходится около 25% общего влияния на снижение функции при развернутой стадии РА. Рентгенологическое прогрессирование также связано с потерей дохода и нетрудоспособностью пациентов [28].
Более быстрое структурное прогрессирование приводит к более выраженной потере функции [29], а снижение скорости рентгенологического прогрессирования – к более благоприятному функциональному исходу [30–32].
В мире широко применяются следующие принципиально отличающиеся друг от друга методы оценки рентгенограмм кистей и стоп при РА [28]:
- по J.T. Sharp – оригинальный метод, опубликованный в 1971 г. [33, 34], на данный момент времени более широко используется в модификациях D.M. van der Heijde [35, 36] и H.K. Genant [37];
- по A. Larsen [38].
Изначально с помощью метода J.T. Sharp можно было оценить 27 суставов на каждой руке и в области запястья, при этом для каждого сустава давалась отдельная характеристика сужения суставной щели и выраженности эрозивного процесса. В дальнейшем для сокращения трудозатрат при чтении рентгенограмм определили 17 областей для оценки эрозий и 18 областей для оценки сужения суставной щели, что повысило точность получаемого результата [39]. В наиболее часто используемой в настоящее время модификации D.M. van der Heijde (метод Sharp/van der Heijde) в отношении сужения суставной щели по шкале от 0 до 4 баллов оцениваются 15 участков каждой кисти и запястья и шесть суставов каждой стопы, в отношении эрозии – 16 участков каждой кисти и запястья и шесть участков каждой стопы (рис. 5).
По методике J.T. Sharp (Total Sharp Score – TSS) рассчитывается сумма баллов сужения суставной щели и эрозий. Возможные значения TSS – от 0 до 448 баллов.
Оценка рентгенограмм кистей и стоп с помощью метода Sharp/van der Heijde выглядит следующим образом [40–42]:
- слабовыраженное повреждение – 3 балла и менее;
- умеренное повреждение – от 4 до 20 баллов;
- значительное повреждение – 21 балл и более;
- выраженная деструкция – счет TSS ≥ 100 баллов;
- клинически значимое изменение и быстрое прогрессирование – более 5 баллов за год;
- отсутствие прогрессирования – 0,5 балла и менее в год.
В модификации H.K. Genant метода J.T. Sharp (метод Sharp/Genant) оцениваются эрозии на 14 участках (от 0 до 3,5 балла для каждого сустава) и сужение суставной щели на 13 участках (от 0 до 4 баллов). Общий балл эрозий и общий балл сужения суставной щели нормализуются исходя из 100 максимальных баллов. Эти два нормализованных балла складываются для получения общего балла, в котором эрозии и сужение суставной щели равномерно взвешены.
Метод A. Larsen позволяет определить общее изменение структуры сустава путем сравнения со стандартными рентгенограммами (рис. 6). Первоначальный метод A. Larsen предполагал оценку всех суставов конечностей, что мало реально в клинической практике. В модификации D.L. Scott [43] подлежат оценке только суставы кистей (включая запястья) и стоп, причем по пятибалльной системе, где 0 баллов соответствует нормальному состоянию сустава, 1 балл отражает легкие, ранние или неспецифические изменения, 2 балла – ранние изменения, характерные для РА, включая одну или несколько эрозий более 1 мм с разрывом кортикального края, 3 балла соответствуют средним деструктивным нарушениям, то есть эрозии на обеих сторонах сустава должны быть значительного размера, 4 балла – серьезному разрушению с подвывихами, 5 баллов – полному разрушению сустава с грубой деформацией костей. Баллы для каждого сустава суммируются, составляя суммарный индекс.
Методы J.T. Sharp и A. Larsen весьма информативны, но редко используются в клинической практике в связи с большой трудоемкостью. Чаще их применяют в клинических испытаниях лекарственных препаратов. Однако о них необходимо знать для правильного понимания научных результатов.
Анкилозирующий спондилит (код по МКБ-10 – М45)
Анкилозирующий спондилит, или болезнь Бехтерева, – хроническое воспалительное заболевание неизвестной этиологии с первичным поражением осевого скелета – крестцово-подвздошных суставов (КПС) и вышележащих отделов позвоночника, в большинстве случаев начинающееся до 45 лет. Оно ассоциируется с антигеном класса I главного комплекса гистосовместимости HLA-B27 [44]. АС относится к группе спондилоартритов, является частным случаем аксиального спондилоартрита (аксСпА) и отличается от нерентгенологического аксиального спондилоартрита (нр-аксСпА) именно наличием характерных рентгенологических признаков. Является ли нр-аксСпА самостоятельным заболеванием или стадией АС, до сих пор не установлено. В любом случае именно АС считается наиболее типичным вариантом аксСпА.
Анкилозирующий спондилит – довольно часто встречающееся заболевание. Так, его распространенность составляет от 0,1 до 1,4% [45].
В первую очередь АС характеризуется развитием воспаления в КПС, суставах и связочном аппарате позвоночника, проявляющегося болью и скованностью, а в отношении структурных изменений – остеопролиферацией с избыточным образованием новой костной ткани, появлением синдесмофитов и анкилозов. Прогрессирование структурных повреждений приводит к значительным функциональным нарушениям вплоть до неподвижности позвоночника [46]. Кроме того, для АС характерны внеаксиальные синдромы (периферический артрит и энтезит), а также внескелетные проявления (передний увеит, возможна ассоциация с псориазом и воспалительными заболеваниями кишечника) [47].
Рентгенологические данные при диагностике АС имеют значительно большее значение, чем при диагностике РА, поскольку входят как в модифицированные Нью-Йоркские критерии для АС 1984 г., так и в более современные классификационные критерии Международного общества по изучению спондилоартритов 2009 г. для аксСпА [48].
Основные изменения, выявляемые на стандартных рентгенограммах
В отличие от РА, при котором первичным проявлением является синовит, для всех спондилоартритов таковым признается энтезит – воспалительное поражение энтезисов, мест прикрепления связок и сухожилий к костям. Это объясняет, почему при АС в отличие от РА основной патологический процесс – ремодуляция костной ткани с преобладанием остеопролиферации, то есть процесс, в определенной степени противоположный деструкции костной ткани [49, 50].
Рентгенологические признаки поражения позвоночника – доказательство того, что имеет место тенденция к выраженной остеопролиферации, потенциально ведущей к анкилозированию – главной характеристике АС, отраженной в названии болезни. На поздней стадии появляются анкилоз КПС и бамбукообразный позвоночник [50]. Необходимо помнить, что эти процессы протекают медленно, как следствие, на выявление остеопролиферации могут потребоваться годы.
Протокол обследования больных с подозрением на АС обязательно включает рентгенографию таза и/или КПС. В ревматологической практике предпочтительной является обзорная рентгенография всего таза, поскольку помимо изменений в КПС она позволяет выявить другие характерные для АС изменения – признаки коксита (сужение суставной щели тазобедренных суставов, субхондральный остеосклероз, нечеткость суставных поверхностей, свидетельствующую об эрозивном процессе), энтезитов (костные разрастания в области прикрепления сухожилий крупных мышц – больших вертелов, седалищных бугров, крыльев подвздошных костей). В дальнейшем при динамическом наблюдении рентгенологическое исследование проводят один раз в год. При установленном диагнозе на развернутой стадии заболевания целесообразно выполнение рентгенографии таза/КПС не чаще одного раза в два года. В случае полного анкилоза КПС рентгенография в динамике нецелесообразна. Однако она может выполняться по специальным показаниям, в частности для оценки динамики изменений в тазобедренных суставах.
Если процесс распространился на вышележащие отделы позвоночника, дополнительно назначают спондилограммы наиболее пораженного участка, обычно поясничного отдела позвоночника.
При классическом варианте АС поражение позвоночника начинается с двустороннего симметричного сакроилиита. В то же время согласно модифицированным Нью-Йоркским критериям 1984 г. также учитывается односторонний сакроилиит, если он достигает третьей или четвертой стадии [48]. К рентгенологическим признакам АС относятся неоднородность и потеря кортикального слоя костной ткани на уровне сочленения, расширение суставной щели. При прогрессировании заболевания определяются эрозии и субхондральный склероз костной ткани суставных поверхностей, образующих сочленения, суставная щель сужается. Рентгенографическая картина сакроилиита при АС имеет тенденцию к прогрессированию с исходом в костный анкилоз. В случае распространения патологического процесса на вышележащие отделы позвоночника определяются костные перемычки (синдесмофиты) между телами позвонков, первоначально, как правило, в местах фиксации передней продольной связки позвоночника. Рентгенография позвоночника в боковой проекции может быть первичным индикатором угрозы развития синдесмофитов, так как позволяет визуализировать признаки переднего спондилита. При воспалительном процессе уменьшается объем передних верхних и нижних углов тел позвонков, выпрямляется вогнутость переднего контура тел, формируется прямоугольная форма передней половины тел позвонков, что служит признаком роста синдесмофитов. Передний спондилит указывает на активность болезни, угрозу анкилозирования в позвоночных сегментах и необходимость проведения интенсивной терапии. Мостовидные синдесмофиты при АС тонкие, симметричные, с ровными, четкими контурами. Одновременно развивается оссификация передней продольной связки. АС вызывает артрит дугоотростчатых суставов позвоночника, прогрессирующий до костного анкилоза. На рентгенограммах в прямой проекции сочетание всех патологических проявлений напоминает типичную картину позвоночника в виде бамбуковой палки.
Возможно формирование спондилодисцита с эрозированием замыкательных пластин позвонков. В этом случае необходима дифференциальная диагностика со спондилодисцитом инфекционного, метастатического происхождения и др.
На фоне сакроилиита у больных АС могут определяться аналогичное поражение лонного сочленения, бахромчатые периоститы и эрозии седалищных бугров, двусторонний коксит.
Протоколы рентгенологических исследований
В настоящее время приняты следующие протоколы рентгенологических исследований при АС [14].
Таз (прямая задняя проекция). Назначение рентгенографии: изучение таза в целом, включая тазовые кости, крестец, крестцово-подвздошные сочленения, лонное сочленение, тазобедренные суставы.
Укладка: снять с пациента верхнюю одежду, уложить его на рентгенографическом столе на спину, руки должны быть вытянуты вдоль туловища, срединная сагиттальная плоскость тела – соответствовать средней линии деки, ноги выпрямлены, разогнуты в тазобедренном и коленном суставах, стопы слегка повернуты внутрь – до 10–15° (большие пальцы соприкасаются), расстояние между пятками – до 4 см, маркировка (правой или левой) стороны исследования.
Центральный луч рентгеновского излучения: направляют перпендикулярно кассете на точку пересечения линии, соединяющей верхние передние ости подвздошной кости, со срединной сагиттальной плоскостью тела, верхний край диафрагмирования области исследования располагается на 4 см выше гребня подвздошной кости.
Правильность укладки: полностью и симметрично выявляются все тазовые кости, включая тазобедренные суставы и крылья подвздошных костей, лонное сочленение соответствует срединной линии, запирательные отверстия по размерам и форме одинаковые, отчетливо определяется латеральный контур большого вертела бедренной кости с обеих сторон.
Информативность рентгенограммы: на рентгенограмме тазовой кости у больных АС выявляются не только патологические изменения КПС, но и воспалительные изменения лонного сочленения (симфизит), бахромчатые периоститы, эрозии седалищных бугров (как отражение бурсита), а также признаки коксартрита. Перечисленные рентгенологические изменения нередки при тяжелом течении АС и имеют значение для оценки динамики процесса. Поскольку сразу визуализируются все зоны поражения, суммарная поглощенная доза ионизирующего излучения снижается.
Установлено, что для динамического наблюдения больных АС нецелесообразно выполнение прицельной рентгенографии крестцово-подвздошных сочленений, лонных сочленений и т.д. Она лишь увеличивает лучевую нагрузку на пациента. Рекомендации по проведению данного исследования натощак и после очистительной клизмы также не выдержали испытание практикой. Следствием выполнения указанных рекомендаций нередко становятся голодные метеоризмы, значительно затрудняющие оценку рентгенограмм.
Крестцово-подвздошные суставы (прямая задняя проекция). Назначение рентгенографии: изучение и оценка крестцовой кости и крестцово-подвздошных суставов – их формы, контуров, размеров.
Укладка: снять с пациента верхнюю одежду, уложить его на рентгенографическом столе на спину, руки должны быть вытянуты вдоль туловища, ноги выпрямлены, разогнуты в тазобедренном и коленном суставах, стопы слегка повернуты внутрь – до 10–15° (большие пальцы соприкасаются), расстояние между пятками – до 4 см, срединная сагиттальная плоскость тела совпадает со средней линией деки стола, у мужчин половые органы экранируются, маркировка (правой или левой) стороны исследования.
Центральный луч рентгеновского излучения направляют:
а) в точку на середину линии, соединяющей верхнюю переднюю ость подвздошной кости справа и слева;
б) в точку на два поперечных пальца выше верхнего края лонного сочленения.
Луч отклоняют от вертикали на 10–30° в краниальном направлении в зависимости от выраженности поясничного лордоза. Фокусное расстояние – 100 см.
Правильность укладки: полностью визуализируются КПС, симметричное изображение крестцовых отверстий.
Информативность рентгенограммы: КПС имеют вид узких полосок просветления, образующих ромб или овал, при воспалительных изменениях четкость контуров суставных поверхностей утрачивается, выявляются очаги локальной деструкции кости.
При рентгенографии КПС в прямой проекции при воспалительных изменениях (сакроилиите) обнаруживаются односторонние или двусторонние изменения, в частности субхондральный остеосклероз суставных поверхностей (более выражен у подвздошных костей), неровность (отражение эрозии) и нечеткость суставных поверхностей сочленений.
Грудной, поясничный отделы позвоночника (прямая проекция). Назначение рентгенографии: изучение позвонков, межпозвонковых дисков, связочного аппарата позвоночника.
Укладка: снять с пациента украшения, верхнюю одежду, уложить его на рентгенографическом столе на спину, руки должны быть вытянуты вдоль туловища, ноги выпрямлены, разогнуты в тазобедренном и коленном суставах, срединная сагиттальная плоскость тела совпадает со средней линией деки стола, половые органы необходимо экранировать, маркировка (правой или левой) стороны исследования.
Центральный луч рентгеновского излучения: на уровне грудного отдела – на центр тела грудины или середину расстояния между вырезкой грудины и верхней границей эпигастральной области, на уровне поясничного отдела – на 3 см выше пупка. Рентгенография выполняется на задержке дыхания после выдоха.
Правильность укладки: хорошо прослеживаются контуры и структура тел позвонков, четкие контуры верхних и нижних замыкательных пластинок, межпозвонковые промежутки и реберно-позвоночные суставы, на уровне поясницы – поперечные отростки и КПС.
Информативность рентгенограммы: вовлечение в патологический процесс отделов позвоночного столба выше крестца приводит к артриту дугоотростчатых суставов и образованию костных перемычек (синдесмофитов) между телами позвонков в местах фиксации к ним передней продольной связки, то есть вдоль латеральной поверхности тел позвонков. Для синдесмофитов при АС характерны ровные и четкие контуры, малая толщина, симметричность по боковым сторонам. На прямой рентгенограмме хорошо визуализируются головки ребер, образующие суставы с телами позвонков.
Грудной, поясничный отделы позвоночника (боковая проекция). Назначение рентгенографии: изучение позвонков, межпозвонковых дисков, связочного аппарата позвоночника.
Укладка: снять с пациента украшения, верхнюю одежду, уложить его на рентгенографическом столе набок, коленные и тазобедренные суставы должны быть слегка согнуты, руки вытянуты кпереди, подняты и сомкнуты над головой, волосы убраны за голову, на уровне грудного отдела – задняя подмышечная линия на уровне средней линии деки стола, на уровне поясничного отдела – средней линии деки стола соответствует фронтальная плоскость на 6–8 см кпереди от поверхности спины, половые органы необходимо экранировать, маркировка (правой или левой) стороны исследования.
Центральный луч рентгеновского излучения: на уровне грудного отдела – на центр тела грудины, на уровне поясничного отдела – на нижний край реберной дуги. Рентгенография выполняется на задержке дыхания после выдоха.
Правильность укладки: хорошо прослеживаются контуры и структура тел позвонков, четкие контуры верхних и нижних замыкательных пластинок, отчетливо видны межпозвонковые промежутки и реберно-позвоночные суставы, дорзальная поверхность тела позвонков четкая, одноконтурная (неудвоенная).
Информативность рентгенограммы: вовлечение в патологический процесс отделов позвоночного столба выше крестца приводит к артриту дугоотростчатых суставов и образованию костных перемычек (синдесмофитов) между телами позвонков в местах фиксации к ним передней продольной связки, то есть передней и латеральной поверхности тел позвонков. Для синдесмофитов при АС характерны ровные и четкие контуры, малая толщина.
Протоколы описания рентгенографии
Протоколы описания рентгенографии КПС должны включать оценку:
- состояния суставной щели крестцово-подвздошных сочленений (ширины просвета рентгеновской суставной щели) – прослеживается на всем протяжении либо частично, сужена или расширена;
- степени анкилозирования с количественным анализом;
- состояния суставных отделов (поверхностей) подвздошных костей, крестца – ровные, неровные, наличие видимых эрозий, субхондральный склероз, его выраженность;
- наличия признаков оссификатов (энтезитов).
Каждое описание рентгенологической картины должно заканчиваться формулировкой заключения с указанием предполагаемого диагноза и рентгенологической степени (стадии) процесса.
Определение стадии
Традиционно стадии АС оценивают по прогрессированию сакроилиита в соответствии с модифицированными Нью-Йоркскими критериями 1984 г. [51–53]. Согласно указанным критериям, выделяют пять стадий АС:
- нулевая стадия – отсутствие изменений;
- первая стадия – подозрение на наличие изменений (незначительное расширение суставной щели, смазанность субхондрального слоя) (рис. 7);
- вторая стадия – минимальные изменения (небольшие локальные области с эрозиями или склерозом в отсутствие изменения ширины щели) (рис. 8);
- третья стадия – безусловные изменения (умеренный или значительный сакроилиит с эрозиями, склерозом, расширением, сужением щели или частичным анкилозом) (рис. 9);
- четвертая стадия – значительные изменения (полный анкилоз) (рис. 10).
Данная классификация, так же как классификация стадий РА по O. Steinbrocker, позволяет описать степень выраженности/необратимости процесса в целом, но не является чувствительной для оценки прогрессирования АС.
Оценка рентгенологического прогрессирования
Новообразование костной ткани в позвоночнике с развитием синдесмофитов обычно расценивается как рентгенографическое прогрессирование воспалительного процесса [50, 54]. Рентгенографическое прогрессирование поражения позвоночника и активность АС являются двумя основными детерминантами нарушения подвижности позвоночника [55].
Оценка структурного прогрессирования при АС более сложная, чем при РА, в связи с целым рядом объективных методических проблем. Поражение разных отделов позвоночника (КПС, поясничного, грудного и шейного) может идти разными темпами. Пролиферативные изменения костной ткани нарастают более медленно, чем эрозивные. Именно поэтому оценивать прогрессирование АС целесообразно не менее чем за два года наблюдения или более [50]. Скорость прогрессирования изменений в позвоночнике характеризуется значительной вариабельностью. При этом отмечается корреляция между темпом прогрессирования и выраженностью воспалительного процесса [56]. Фактором последующего прогрессирования является наличие синдесмофитов [57].
В настоящее время наиболее распространенными вариантами количественной оценки выраженности и прогрессирования рентгенологических изменений в позвоночнике при АС являются:
- модифицированная шкала оценки анкилозирующего спондилита Stoke (Stoke Ankylosing Spondylitis Spine Score – mSASSS) [58];
- шкала рентгенографической оценки анкилозирующего спондилита позвоночника (Radiographic Ankylosing Spondylitis Spinal Score – RASSS) [59].
Сравнительная характеристика данных методов представлена в табл. 2 [58–60].
Первая методика (mSASSS) применяется чаще и подразумевает оценку верхней и нижней передних краевых каемок шейных и поясничных позвонков в боковой проекции с нижней границы C2 до верхней границы Th1, а также с нижней границы Th12 до верхней границы S1 соответственно. Структурные изменения каждой каемки ранжируются от 0 до 3 баллов, где 0 баллов обозначает «без изменений», 1 балл – наличие эрозий, квадратизацию тел позвонков или остеосклероз, 2 балла – наличие синдесмофитов, 3 балла – наличие синдесмофитов, соединяющих позвонки (костные мостики). Максимальное значение по mSASSS – 72 балла [58]. Данная методика не учитывает вовлечение в процесс фасеточных суставов. Консенсус в отношении определения рентгенологического прогрессирования АС не достигнут. Одни исследователи предлагают определять прогрессирование АС как увеличение mSASSS на две единицы и более в течение двух лет, другие – любое повышение показателя с течением времени [61].
В настоящее время mSASSS применяется достаточно широко в научных исследованиях и в определенной степени становится стандартом для оценки структурно-модифицирующего действия современных лекарственных препаратов [62, 63].
Разработана также комплексная количественная оценка рентгенологических изменений при АС – Батский рентгенологический индекс анкилозирующего спондилита (Bath Ankylosing Spondylitis Radiology Index – BASRI) [64]. Этот инструмент включает оценку КПС (BASRI-SI), тазобедренных суставов (BASRI-hips) и позвоночника (BASRI-spine) (табл. 3). Каждый из компонентов может рассматриваться по отдельности. Вместе они формируют единый индекс.
Сравнительные исследования с применением разных рентгенологических индексов дали противоречивые результаты. BASRI проще и быстрее, а mSASSS обеспечивает лучшую согласованность оценки разными рентгенологами при меньшей лучевой нагрузке [65–68]. В клинической практике количественные методы оценки рентгенологического прогрессирования при АС применяются редко, хотя, несомненно, заслуживают более широкого внедрения
Д.Е. Каратеев
Е.А. Степанова
Е.Л. Лучихина
Московский областной научно-исследовательский клинический институт им. М.Ф. Владимирского
Адрес для переписки: Дмитрий Евгеньевич Каратеев, dekar@inbox.ru
Для цитирования: Каратеев Д.Е., Степанова Е.А., Лучихина Е.Л. Методические рекомендации по рентгенологическим методам исследования при ревматоидном артрите и анкилозирующем спондилите. Эффективная фармакотерапия. 2022; 18 (18): 12–25.
DOI 10.33978/2307-3586-2022-18-18-12-25