Гранулематоз Вегенера
Гранулематоз Вегенера или гранулематоз с полиангиитом (ГПА) — васкулит, связанный с антинейтрофильными цитоплазматическими антителами. Это редкое мультисистемное заболевание, поражающее преимущественно мелкие сосуды, которое характеризуется гранулематозным воспалением, малоиммунным некротизирующим гломерулонефритом и васкулитом. ГПА может поражать практически любой орган. Клинические проявления неоднородны и могут быть классифицированы как гранулематозные (например, заболевания уха, носа и горла; узелки или массы в легких; ретроорбитальные опухоли; пахименингит) или васкулитные (например, гломерулонефрит, альвеолярное кровоизлияние, множественный мононеврит, склерит). Диагноз ГПА основывается на сочетании клинических данных, результатов визуализационных исследований, результатов лабораторных тестов, серологических маркеров и гистопатологических результатов. Радиология играет решающую роль в диагностике и последующем наблюдении пациентов с ГПА. КТ и МРТ являются основными методами визуализации, используемыми для оценки проявлений ГПА, позволяя дифференцировать ГПА от других заболеваний, которые могут симулировать ГПА. Авторы рассматривают основные клинические, гистопатологические и визуальные особенности ГПА для решения дифференциальной диагностики пораженных органов и предоставляют панорамную картину многообразных проявлений этого редкого заболевания. Гетерогенные проявления ГПА представляют собой значительную проблему в диагностике этого редкого состояния. Распознавая общие и необычные результаты визуализации, радиологи играют важную роль в диагностике и последующем наблюдении пациентов с ГПА и помогают врачам в дифференциации активности заболевания от вызванного болезнью повреждения, что в конечном итоге влияет на терапевтические решения.
Введение
Гранулематоз с полиангиитом (ГПА), ранее гранулематоз Вегенера, является васкулитом, связанным с антинейтрофильными цитоплазматическими антителами (ANCA). Это редкое мультисистемное заболевание, поражающее преимущественно мелкие сосуды и характеризующееся гранулематозным воспалением, малоиммунным некротизирующим гломерулонефритом и васкулитом, приводящим к повреждению эндотелия и тканей ( 1 ). В 1931 году Клингер дал первое описание ГПА: вариант узелкового полиартериита. Позднее, в 1936 и 1939 годах, Вегенер подробно описал отдельный синдром ( 2 ).
GPA является редким заболеванием, с предполагаемой частотой от 0,4 до 11,9 случаев на 1 миллион человеко-лет. GPA страдают одинаковое количество мужчин и женщин, с возрастом начала заболевания 45–65 лет и более высокой распространенностью среди белых людей ( 1 , 3 , 4 ). Заболеваемость GPA, по-видимому, возросла за последние десятилетия, возможно, из-за большей осведомленности об этом состоянии после введения тестирования ANCA ( 5 ).
Точные патогенетические механизмы GPA остаются неизвестными. Инфекционные, экологические, химические, токсические и фармакологические триггеры у генетически предрасположенных людей могут влиять на начало заболевания ( 3 ). Описана генетическая ассоциация с HLA-DP, SERPINA1 и PRTN3 ( 6 ). Гипотезы относительно патогенетических механизмов GPA включают участие инфекционного агента ( Staphylococcus aureus ), активирующего иммунную систему; роль В-клеток в продукции ANCA; и дисбаланс в различных подтипах Т-клеток и цитокин-хемокиновых сетях, участвующих в разрыве толерантности, запуская аутоиммунитет и/или окислительный взрыв в направлении эндотелиальных клеток ( 5 , 6 ).
ANCA, направленные против протеиназы 3, присутствуют примерно у 65–75% людей с ГПА, а ANCA, направленные против миелопероксидазы, присутствуют у 20–30% этих людей ( 4 ). Эти антитела участвуют в активации циркулирующих подготовленных нейтрофилов, заставляя их прикрепляться к стенкам сосудов, проникать в них и повреждать их, подвергаясь респираторному взрыву, дегрануляции, НЕТозу (образованию нейтрофильных внеклеточных ловушек), апоптозу и некрозу ( 5 , 6 ).
В 1990 году Американский колледж ревматологии разработал первый формальный набор критериев для классификации ГПА. Наличие по крайней мере двух из следующих четырех критериев для целей классификации имеет 88,2% чувствительности и 92,0% специфичности: воспаление носа или рта, аномальные результаты рентгенографии грудной клетки, мочевой осадок и гранулематозное воспаление при биопсии ( 7 ).
Совсем недавно, в 2017 году, Американский колледж ревматологии и Европейская лига против ревматизма предложили пересмотренные критерии классификации для GPA, которые имели хорошую чувствительность (93%) и специфичность (94%). С этими критериями рассматриваются как клинические, так и лабораторные параметры, включая результаты тестирования ANCA и исследования визуализации, и к каждому критерию применяется разный вес или оценка. Узелки, массы или полости на снимках грудной клетки; а также воспаление, уплотнение или выпот в носовых или околоносовых пазухах являются одними из результатов визуализации ( 8 ).
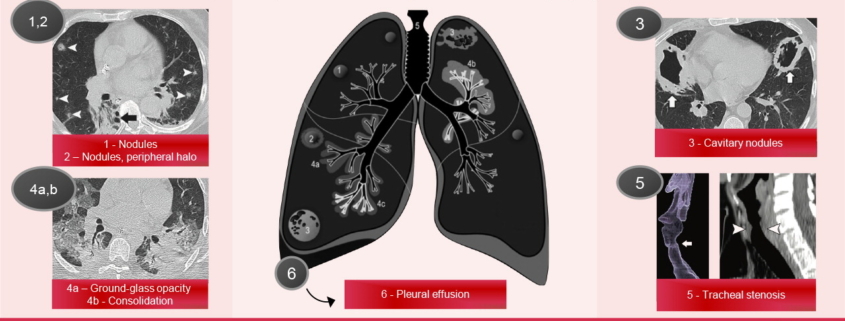
Фактически любой орган может быть вовлечен в ГПА. Часто присутствуют симптомы системного воспаления, такие как лихорадка, потеря веса, недомогание, артралгия, миалгия и усталость. Клинические проявления неоднородны и могут быть классифицированы как гранулематозные проявления (например, заболевания уха, носа и горла; узелки или массы в легких, ретроорбитальные опухоли, пахименингит), которые связаны с повышенным риском рецидива, или васкулитные проявления (например, гломерулонефрит, альвеолярное кровоизлияние, множественный мононеврит, склерит), которые связаны с повышенной смертностью ( 9 ). Клинические проявления ГПА изображены на рисунке 1 .

 Диагностика ГПА основывается на сочетании клинических данных, результатов визуализационных исследований, лабораторных показателей (например, маркеров воспаления, таких как скорость оседания эритроцитов и С-реактивный белок, общий анализ крови, а также почечные и мочевые параметры), серологических маркеров (тестирование на ANCA) и гистопатологических результатов, если возможно проведение биопсии.
Диагностика ГПА основывается на сочетании клинических данных, результатов визуализационных исследований, лабораторных показателей (например, маркеров воспаления, таких как скорость оседания эритроцитов и С-реактивный белок, общий анализ крови, а также почечные и мочевые параметры), серологических маркеров (тестирование на ANCA) и гистопатологических результатов, если возможно проведение биопсии.( 5 ). Различие между активным заболеванием и вызванным заболеванием повреждением является важным и имеет терапевтические и прогностические последствия ( 10 , 11 ). Радиология играет решающую роль в диагностике и наблюдении пациентов с ГПА. КТ и МРТ являются основными методами визуализации, используемыми для оценки проявлений ГПА, позволяя дифференцировать ГПА от других заболеваний, которые могут имитировать ГПА. Дифференциальная диагностика ГПА обобщена в таблице .
Гранулематоз Вегенера
 |
После внедрения иммунодепрессантной терапии 5-летняя выживаемость среди лиц с ГПА составляла приблизительно 70–80% в течение последних 40–50 лет ( 4 ). Лечение ГПА включает две фазы: индукцию ремиссии (первые 3–6 месяцев) на основе терапии комбинацией глюкокортикоидов и циклофосфамида или ритуксимаба и поддерживающую терапию (следующие 24–48 месяцев), направленную на предотвращение рецидива заболевания, на основе терапии низкими дозами глюкокортикоидов и ритуксимаба, азатиоприна, метотрексата или микофенолата мофетила ( 5 , 12 ).
В этой статье мы рассмотрим основные клинические, гистопатологические и визуальные особенности ГПА, рассмотрим дифференциальную диагностику пораженных органов и представим панорамную картину многообразных проявлений этого редкого заболевания.
Голова и шея
Голова и шея поражаются у 90% пациентов с ГПА, являясь областями проявления симптомов у 73% из них, а наиболее часто поражаемыми участками являются нос, глаза, уши и рот ( 13 , 14 ). Неврологическое поражение при ГПА наблюдается у 22%–54% этих пациентов. Периферическая нейропатия и гранулематозные орбитальные массы являются наиболее распространенными неврологическими проявлениями, встречающимися у 10%–45% пациентов с ГПА ( 15 ). Если исключить параличи черепных нервов из проявлений центральной нервной системы (ЦНС), поражение ЦНС встречается редко, наблюдаясь у 7%–11% пациентов с ГПА на момент постановки диагноза или во время обострений ( 16 , 17 ). Прямое распространение гранулематозного процесса, васкулит сосудов головного мозга и прямое образование гранулем в паренхиме мозга являются патогенетическими механизмами, предполагаемыми при поражении ЦНС ( 18 ).
Мозговые оболочки
Пахименингит, расстройство, вызванное локализованным или диффузным утолщением внутричерепной или спинальной твердой мозговой оболочки, было зарегистрировано у 0,6%–8,0% пациентов с ГПА ( 19 ). Он считается гранулематозным проявлением ГПА, поскольку хронический гипертрофический пахименингит встречается чаще, чем лептоменингит ( 15 ). Хронический гипертрофический пахименингит может возникать как начальное проявление ГПА или как единственное место активного заболевания ( 20 ). Хотя это проявление считается редким, оно может быть причиной других более распространенных неврологических проявлений, таких как краниальные невропатии с постоянным повреждением, головная боль, несахарный диабет, гидроцефалия и офтальмоплегия ( 21 ).
Симптомы включают сильную хроническую головную боль, которая не поддается лечению обычными анальгетиками, но поддается лечению кортикостероидами, множественный паралич черепных нервов (чаще всего III, VI, VII и X), менингизм, судороги, энцефалопатию, экзофтальм, атаксию, нечеткость зрения, паралич конечностей и параплегию (из-за поражения спинного мозга) ( 15 , 20 , 22 ).
 МРТ с контрастным веществом на основе гадолиния является методом визуализации выбора для выявления менингеального поражения при ГПА. Он полезен для определения того, развился ли менингит in situ или из экстракраниальных участков, и отображает диффузное или очаговое утолщение твердой мозговой оболочки в 75% случаев ГПА ( рис. 2 ) и вовлечение лептоменингеальной оболочки в остальных случаях
МРТ с контрастным веществом на основе гадолиния является методом визуализации выбора для выявления менингеального поражения при ГПА. Он полезен для определения того, развился ли менингит in situ или из экстракраниальных участков, и отображает диффузное или очаговое утолщение твердой мозговой оболочки в 75% случаев ГПА ( рис. 2 ) и вовлечение лептоменингеальной оболочки в остальных случаях( Рис. 3 ) ( 21 , 23 ). Были описаны два типа распределения: диффузно аномальные мозговые оболочки, не связанные с заболеванием пазух или орбиты, и очаговое утолщение твердой мозговой оболочки и усиление, прилегающее к заболеванию пазух или орбиты ( 24 ). Тенториальное поражение встречается очень часто ( 22 ). Дополнительные паттерны и места усиления включают линейные или узловые, периферические или однородные, симметричные или асимметричные ( 25 ). Знак «Эйфеля ночью» на МРТ представляет собой утолщенную твердую мозговую оболочку в заднем серпе и тенториуме из-за фиброза, видимого как центральная гипоинтенсивность на контрастно-усиленных изображениях T1 с жировым насыщением, с усилением периферии, представляющей области активного воспаления ( Рис. 4 ) ( 25 ). Напротив, чувствительность КТ для этих поражений низкая ( 20 ).



Анализ спинномозговой жидкости полезен для исключения инфекций и может дать нормальные результаты или показать неспецифические отклонения, такие как лимфоцитарный плеоцитоз, гиперпротеиноррахия или повышенное давление открытия ( 15 , 23 ). Менингеальная биопсия должна быть зарезервирована для случаев, в которых есть подозрение на неопластический менингит или реакция на лечение неадекватна. Биопсия может выявить гранулематозное воспаление, васкулит мелких сосудов или комбинацию этих нарушений. Реже биопсия выявляет лимфоцитарное воспаление и фиброзное утолщение ( 15 , 20 , 22 ). Неврологические осложнения распространены у пациентов с пахименингитом спинного мозга и васкулитными (геморрагическими или ишемическими) поражениями и реже у пациентов с церебральным пахименингитом ( 16 ).
Мозговая паренхима
Васкулит мелких сосудов головного мозга, наиболее распространенное паренхиматозное проявление у пациентов с ГПА, был зарегистрирован примерно у 4% пораженных пациентов и связан с внутримозговым или субарахноидальным кровоизлиянием, транзиторными ишемическими атаками, ишемическим инфарктом ( рис. 5 ), субдуральной гематомой ( рис. 6 ), ишемической миелопатией и артериальным или венозным тромбозом ( рис. 7 ) ( 23 , 26 , 27 ). Инфаркты головного мозга могут быть вызваны артериальной окклюзией, вторичной по отношению к гранулематозной массе, которая простирается от носовых или околоносовых участков до основания черепа, тогда как наименее распространенными формами поражения ЦНС при ГПА являются отдаленные гранулематозные поражения в паренхиме мозга ( рис. 8 ) ( 24 ). Клинические проявления церебрального васкулита включают парезы, судороги, изменение сознания, энцефалопатию, когнитивные нарушения, потерю зрения, корковую слепоту и деменцию ( 27 ).




 Диагностика васкулита ЦНС является сложной задачей, особенно из-за трудности дифференциации этого состояния от сосудистого атеросклеротического заболевания ( 27 ). Результаты МРТ церебрального васкулита включают множественные неспецифические поражения белого вещества с неоднородной высокой интенсивностью сигнала T2 в типичном сосудистом распределении (перивентрикулярные, подкорковые области, базальные ганглии, средний мозг и мост)
Диагностика васкулита ЦНС является сложной задачей, особенно из-за трудности дифференциации этого состояния от сосудистого атеросклеротического заболевания ( 27 ). Результаты МРТ церебрального васкулита включают множественные неспецифические поражения белого вещества с неоднородной высокой интенсивностью сигнала T2 в типичном сосудистом распределении (перивентрикулярные, подкорковые области, базальные ганглии, средний мозг и мост)( 26 , 28 ). Диффузионно-взвешенные изображения могут отображать области инфаркта, а контрастно-усиленные МРТ-изображения могут показывать неоднородные области усиления ( 26 ). Геморрагические события случаются реже и обычно поражают паренхиму мозга и субарахноидальное пространство ( 28 ). Также сообщается о церебральной атрофии, которая, возможно, связана с церебральным васкулитом и лечением кортикостероидами, тогда как функциональные МРТ-исследования у пациентов с ГПА ( 24 , 29 ) показали, что усталость может быть связана со стриатоталамофронтальными структурами мозга.
Обычная ангиография не подходит для выявления васкулита мелких сосудов (50–300 мкм), поскольку размер мелких сосудов, обычно поражаемых ГПА, ниже разрешения обычной ангиографии (500 мкм) ( 30 ). Поэтому часто наблюдаются отрицательные результаты церебральной ангиографии. Однако в отчетах о случаях ( 31 ) было показано вовлечение внутренней сонной артерии, мозговых и глазных артерий с улучшением после лечения ( Рис. E1 ).
Синдром задней обратимой энцефалопатии — редкое осложнение, которое клинически проявляется острым началом энцефалопатии, судорогами, головной болью и нарушением зрения. Рентгенологически синдром задней обратимой энцефалопатии проявляется вазогенным отеком, который преимущественно затрагивает двусторонние теменно-затылочные области ( 28 ). Более того, изолированные паренхиматозные массы встречаются редко. Клинически они проявляются судорогами, а рентгенологически — четко очерченными гранулемами с высокой интенсивностью сигнала на Т2-взвешенных МРТ-изображениях и усилением на МРТ-изображениях с усилением гадолинием ( 28 ).
Гистологически подтвержденный васкулит ЦНС встречается очень редко, и биопсия при этом заболевании часто невозможна ( 30 ). Образцы биопсии мозга из твердой мозговой оболочки, мозговой паренхимы и лептоменингеальной оболочки выявляют некротизирующий васкулит, поражающий мелкие и средние сосуды, гранулематоз с инфильтрацией воспалительных клеток (моноцитов, плазматических клеток, эозинофилов и полиморфноядерных лейкоцитов), фибриноидный некроз и отек ( 28 ).
Гипофиз
Поражение гипофиза наблюдается менее чем в 1% случаев ГПА, чаще во время течения заболевания, чем до постановки диагноза, и у молодых людей, с преобладанием женщин ( 32 , 33 ). У большинства пациентов с поражением гипофиза поражаются и другие органы ( 34 ). Гипофиз и инфундибулум могут быть вовлечены в ГПА посредством отдаленных гранулем или прямого распространения из носовой, околоносовой или орбитальной болезни и, следовательно, связаны с гранулематозным, а не васкулитным компонентом заболевания ( 24 , 33 ).
Наиболее частыми нарушениями гипофиза при ГПА являются несахарный диабет и вторичный гипогонадизм, хотя может наблюдаться и пангипопитуитаризм ( 34 ). Компрессионные симптомы этих нарушений включают головную боль, рвоту и дефекты поля зрения. Напротив, гормональные нарушения проявляются полиурией, полидипсией, астенией, аменореей, галактореей, снижением либидо и мышечной атрофией ( 34 ).
МРТ гипофиза выявляет увеличенную железу с гетерогенным или гомогенным усилением; кистозные изменения; повышенное усиление и утолщение инфундибулума; и потерю задней гиперинтенсивности на T1-взвешенных МР-изображениях (особенно у пациентов с центральным несахарным диабетом из-за значительного снижения содержания вазопрессина в задней доле гипофиза). Утолщение (ширина >3,5 мм), аномальное усиление и сжатие ножки ( рис. 9 ) также можно увидеть на МРТ ( 26 , 27 , 32 , 33 ). Разрешение изменений на МРТ не всегда коррелирует с клиническим улучшением функции гипофиза, и наоборот. Однако у 62%–86% пациентов дефицит гормонов может сохраняться, несмотря на адекватную системную реакцию на заболевание, вероятно , из-за постоянного повреждения гипофиза, связанного с некротизирующим гранулематозным воспалением железы ( 32–34 ). Анализ спинномозговой жидкости можно использовать для исключения других клинических состояний, таких как инфекция, лимфома и гистиоцитоз из клеток Лангерганса ( 34 ).

Биопсия гипофиза не является обязательной для подтверждения гипофизита, связанного с ГПА ( 18 ). Гистопатологический анализ выявляет полиморфные воспалительные изменения и/или гранулемы с лимфоцитами и плазматическими клетками ( 27 ).
Черепно-мозговые нервы
Краниальные нейропатии нечасты при ГПА; они могут возникать как единичные или множественные аномалии и чаще всего являются вторичными по отношению к инфильтрации гранулемы из околоносовых пазух ( 35 ). Частота краниальных нейропатий, зарегистрированных в нескольких когортах, колеблется от 2% до 10%, и может быть сложно поставить диагноз, особенно когда эти нейропатии возникают как изолированные проявления ( 23 , 30 , 36 ).
Чаще всего поражаются зрительные и обонятельные нервы; периферические черепные нервы (III–XII) поражаются вдоль их экстракраниального пути, а параличи черепных нервов III, V, VI, VII и VIII присутствуют примерно у 50% пациентов с пахименингитом ( 15 ). Зрительный нерв может быть поражен васкулитом, прямым воспалением невральной оболочки или острым сдавлением гранулематозными массами в глазнице, что приводит к атрофии и потере зрения ( 15 , 37 ). Изолированные или множественные краниальные невропатии при отсутствии пахименингита встречаются редко и обычно приписываются васкулитному процессу ( 23 ).
МРТ выявляет воспалительные изменения с сопутствующим утолщением и усилением соседних черепных нервов; в частности, острый неврит зрительного нерва проявляется как гиперинтенсивность сигнала в увеличенном усиленном зрительном нерве ( 26 ) ( рис. 10 ). Для определения границ поражения необходимы короткие τ-инверсия-восстановление и контрастно-усиленные T1-взвешенные изображения с подавлением жира.

Височные кости
Распространенность поражения отоларингологии варьируется от 19% до 61 %. Поражение отоларингологии является симптомом в 20%–25% случаев ГПА и почти всегда является вторичным по отношению к поражению носа ( 38–40 ). Его подразделяют на серозный средний отит, хронический средний отит, нейросенсорную потерю слуха , вертиго или паралич лицевого нерва ( 41 ).
Среднее ухо поражается в 40–70% случаев ГПА ( 42 ). Наиболее распространенным проявлением является односторонний или двусторонний серозный средний отит из-за гранулематозной обструкции евстахиевой трубы, который может осложняться параличом лицевого нерва у 8–10% пациентов и мастоидитом ( 14 , 39 ). Кроме того, может возникнуть деструкция среднего уха и сосцевидной полости ( 40 ).
Постепенная или флуктуирующая потеря слуха, вызванная кондуктивной (более распространенной), сенсоневральной или смешанной потерей слуха, встречается у 6% пациентов с ГПА, и может быть двусторонней в 60% случаев ( 38 ). Сенсоневральная потеря слуха является результатом васкулитного поражения улиткового кровоснабжения или отложения иммунных комплексов в улитке, тогда как кондуктивная потеря слуха часто сохраняется из-за утолщенной, рубцовой и часто перфорированной барабанной перепонки и спаек среднего уха ( 14 , 42 ).
Результаты визуализации височных костей включают помутнение среднего уха или сосцевидного отростка с утолщением костных перегородок и костную деминерализацию или эрозию ( рис. 11 ) ( 26 , 43 ). Кроме того, результаты МРТ включают утолщение и усиление соседних черепных нервов, чаще всего сосцевидного и барабанного сегментов черепного нерва VII, со сглаживанием окружающего жира в отверстиях основания черепа. Усиление базального кохлеарного поворота может наблюдаться у пациентов с лабиринтитом, тогда как усиление вестибулярного отдела встречается реже ( 44 ).

Орбита и глаз
Поражение орбиты происходит в ходе заболевания у 45% пациентов с ГПА и как симптом у 16% этих пациентов ( 45 ). Гранулематозные массы, возникающие из носовых или околоносовых полостей, могут перфорировать кость и проникать в структуры ЦНС, такие как мозговые оболочки, мозг и глазница. Более того, орбитальные массы могут возникать в первую очередь внутри глазницы, особенно в ее вершине ( 15 ). Эти массы могут также распространяться внутричерепно вдоль щелей или отверстий основания черепа ( 43 ).
Орбитальные массы чаще бывают односторонними (86% случаев), имеют экстракональное или транспространственное распространение и часто сосуществуют с заболеванием околоносовых пазух и/или деструкцией костей ( 15 , 26 ). Клинические проявления включают сильную боль в орбите, экзофтальм (2% пациентов), диплопию, отек века, периорбитальный целлюлит, нарушение движения глаз и потерю зрения из-за компрессии зрительного нерва и атрофии, которая может быть постоянной у 8% пациентов ( 15 , 42 ).
У 50%–60% пациентов в ходе заболевания происходит поражение глаз. Эписклерит является наиболее распространенным глазным проявлением, присутствующим в 16%–38% случаев ГПА ( 42 ). Увеит, склерит, изъязвление века и свищ, конъюнктивит, изъязвление роговицы, хориоидальные гранулемы, интерстициальный кератит, ретинальная сосудистая ишемия или окклюзия и обструкция носослезного протока с эпифорой являются дополнительными глазными проявлениями ( 14 , 42 , 46 , 47 ). Оптический периневрит встречается чаще, чем оптический неврит ( рис. E2 ). Основными причинами потери зрения являются компрессионная оптическая нейропатия, васкулит сетчатки и зрительного нерва, а также перфорация глазного яблока из-за некротизирующего склерита и периферического язвенного кератита ( 48 ).
На МРТ орбитальные массы отображаются как гипоинтенсивные поражения на изображениях, взвешенных по T1 и T2, с поглощением контрастного вещества на основе гадолиния во время острой фазы воспаления ( рис. 12 ) ( 15 ). Дополнительные результаты визуализации включают контрактуру глазничной впадины с рентгенологическими признаками фиброзных изменений, втягивающих зрительное яблоко, увеличение слезной железы и экстраокулярной мышцы, а также усиление оболочки зрительного нерва ( 15 , 43 ). Рост воспалительной ткани приводит к образованию псевдоопухоли глазницы ( рис. 13 ) с последующим экзофтальмом ( 26 ).
![GPA у 36-летнего мужчины. (A, B) Аксиальные (A) и коронарные (B) контрастно-усиленные T1-взвешенные изображения МРТ показывают поражение, окружающее каналикулярную часть правого зрительного нерва с гетерогенным усилением (стрелка). Также отмечается утолщение узелков, усиливающее дуральную оболочку (наконечники стрелок на A). (C) Биопсия ткани орбиты показывает панорамный вид с плотным воспалительным инфильтратом в мягких тканях и географическим некрозом с абсцессами (наконечники стрелок). (Окраска гематоксилином-эозином [HE]; исходное увеличение ×40.) (D) Микрофотография показывает небольшой сосуд с закупоренным просветом (*) и воспалительным инфильтратом, состоящим из эпителиоидных гистиоцитов, нейтрофилов, лимфоцитов, рассеянных эозинофилов и кариоретических остатков в стенке. (Окраска HE; исходное увеличение ×400.) GPA у 36-летнего мужчины. (A, B) Аксиальные (A) и коронарные (B) контрастно-усиленные T1-взвешенные изображения МРТ показывают поражение, окружающее каналикулярную часть правого зрительного нерва с гетерогенным усилением (стрелка). Также отмечается утолщение узелков, усиливающее дуральную оболочку (наконечники стрелок на A). (C) Биопсия ткани орбиты показывает панорамный вид с плотным воспалительным инфильтратом в мягких тканях и географическим некрозом с абсцессами (наконечники стрелок). (Окраска гематоксилином-эозином [HE]; исходное увеличение ×40.) (D) Микрофотография показывает небольшой сосуд с закупоренным просветом (*) и воспалительным инфильтратом, состоящим из эпителиоидных гистиоцитов, нейтрофилов, лимфоцитов, рассеянных эозинофилов и кариоретических остатков в стенке. (Окраска HE; исходное увеличение ×400.)](https://pubs.rsna.org/cms/10.1148/rg.2021210132/asset/images/medium/rg.2021210132.fig12.gif)


Полость рта и слюнные железы
Проявления в полости рта редки и включают «клубничную» гиперплазию десен, язвенный стоматит, хроническое воспаление, гранулемы, ороантральный свищ, остеонекроз неба и узелки слизистой оболочки губ ( 42 ). Крупные слюнные железы (околоушные и подчелюстные железы) являются редким местом поражения при ГПА и представляют собой ранний признак заболевания ( 13 , 49 ). В более чем 40 отчетах о случаях околоушные железы были поражены чаще всего (78%), и это поражение может быть односторонним или двусторонним ( 50 ). Результаты визуализации неспецифичны и состоят из гетерогенного увеличения и гиперусиления крупных слюнных желез на КТ и МРТ изображениях ( рис. 15 ); низкая интенсивность сигнала на Т2-взвешенных МРТ изображениях, предполагающая наличие некротических очагов; и ограниченная кистозная или заполненная жидкостью масса на снимках УЗИ, даже в клинически непораженной железе ( 13 , 50 ). Гистопатологические данные слюнных желез включают географический некроз, гранулемы, гигантские клетки, микроабсцессы, некротическое гранулематозное воспаление, васкулит мелких сосудов, ксантогранулематозные поражения и фиброз ( 13 ).

Верхние и нижние дыхательные пути
Нос и околоносовые пазухи
Нос и околоносовые пазухи являются участками, наиболее часто поражаемыми ГПА в области головы и шеи, с распространенностью поражения носа 64%–80% и 29%–36% пациентов с генерализованным и локализованным заболеванием соответственно ( 11 , 39 ). Поражение носа проявляется частым образованием корок, серозно-кровянистыми выделениями, обструкцией, симптомами хронического риносинусита, рецидивирующим носовым кровотечением, лицевой болью, гипосмией, аносмией или какосмией ( 11 , 39 , 46 , 51 ). Клиническое обследование выявляет образование корок в носу (чаще на носовых раковинах и перегородке), рыхлую эритематозную слизистую оболочку, грануляции, признаки синусита, эрозированный и изъязвленный сошник, булыжную мостовую слизистой, отек, перфорацию перегородки и седловидную деформацию носа ( рис. 16C ), причем последняя присутствует у 10–25% пациентов из-за разрушения хряща перегородки с последующим коллапсом носа ( 11 , 14 , 39 , 42 ). Передняя носовая перегородка, известная как сплетение Киссельбаха, является одной из наиболее часто поражаемых областей ( 14 ). Хронический синусит встречается в 50% случаев поражения носа ( 42 ).

 На ранних стадиях ГПА МРТ носа и околоносовых пазух не позволяет дифференцировать воспаление слизистой оболочки и гранулематозную ткань, тогда как на поздних стадиях гранулемы видны как очаги с низкой интенсивностью сигнала на МРТ ( 39 ). КТ может быть полезна в случаях разрушения костей и внутричерепного распространения носовых поражений
На ранних стадиях ГПА МРТ носа и околоносовых пазух не позволяет дифференцировать воспаление слизистой оболочки и гранулематозную ткань, тогда как на поздних стадиях гранулемы видны как очаги с низкой интенсивностью сигнала на МРТ ( 39 ). КТ может быть полезна в случаях разрушения костей и внутричерепного распространения носовых поражений( 39 ). Наиболее частыми результатами КТ являются утолщение слизистой оболочки (у 87% пациентов) и деструкция костей (у 59% пациентов) ( 52 ).
Результаты визуализации придаточных пазух носа включают изменения костей (деструкция перегородки, гребешковая деформация, склероз, неоостеогенез и кальцификация [ Рис. 16A ] околоносовых пазух и большого крыла клиновидной кости), помутнение пазух и утолщение слизистой оболочки с узловатым рисунком, в первую очередь верхнечелюстных пазух ( 14 , 26 , 45 ). Образование гранулемы (присутствует в 14,5% случаев) может привести к костной эрозии (с предпочтением передней решетчатой области) и прогрессирующему разрушению хряща ( Рис. 16 ) ( 26 , 43 , 52 ). Деструктивный процесс изначально локализуется в средней линии перегородки и носовых раковинах и распространяется симметрично на соседнюю антральную полость, а затем на остальные пазухи, в результате чего образуется большая единая полость пазухи ( 26 ). При использовании костного окна склеротические изменения в стенках пазухи можно увидеть как слегка неровную двойную линию на стенке пазухи. Эта двойная линия состоит из нового кортикального края внутри нормальной кости и отделена областью менее плотной кости ( рис. 17 ) ( 53 ).

Гортань и трахеобронхиальное дерево
Поражение дыхательных путей наблюдается у 15–55% пациентов с ГПА, обычно у молодых пациентов и в сочетании с другими проявлениями заболевания ( 55 ). Поражение гортани, позднее проявление ГПА, проявляется в виде циркулярного подсвязочного стеноза (9–16% пациентов) и гладкого или узлового утолщения стенки, обычно без вовлечения голосовых связок или дистальной части трахеи ( 14 , 39 , 42 ).
Клинические проявления поражения дыхательных путей включают прогрессирующую одышку, острый стридор и хрипы, реже кровохарканье, кашель и осиплость голоса ( 42 , 51 , 55 ). Трахеобронхиальное поражение обычно связано с заболеванием, которое поражает надгортанные структуры, легочную паренхиму и другие органы, тогда как поражение задней мембраны трахеи помогает отличить ГПА от других заболеваний ( 55 ).
Поражение трахеобронхиального дерева, наряду с легочными узелками или массами, является одним из основных результатов КТ при ГПА. Результаты КТ также включают очаговый (чаще), сегментарный, мультифокальный или удлиненный сегменты стеноза; мягкие ткани медиально от перстневидного хряща ( рис. 18 ); кальцификацию и утолщение колец трахеи; перибронхиальное утолщение мелких дыхательных путей на сегментарном и субсегментарном уровнях бронхов; и реже бронхоэктазы ( 43 , 55 ).

МРТ является ценным диагностическим инструментом визуализации у пациентов с ГПА с поражением подсвязочной области. Он полезен для оценки воспалительной подсвязочной активности с чувствительностью и специфичностью 87,5% и 60,0% соответственно и отрицательной прогностической ценностью 85,7%. В частности, T1-взвешенные МР-изображения показывают утолщение и сужение подсвязочной области, тогда как короткие τ-инверсионно-восстановительные МР-изображения показывают повышенную интенсивность сигнала при наличии отека с чувствительностью 100% и специфичностью 60% для активного воспаления ( 56 ).
Гистопатологический анализ часто выявляет грануляционную ткань или неспецифическое воспаление и реже выявляет васкулит, некроз, образование микроабсцессов и разбросанные гигантские клетки ( 55 ). Поражение гортани и трахеи может оказаться фатальным, если его не лечить, тогда как 50% пациентов с поражением гортани в какой-то момент потребуется трахеостомия ( Рис. E3 ) ( 14 , 42 ). В дополнение к медикаментозной терапии, для лечения поражения дыхательных путей требуются бронхоскопические вмешательства и хирургическое вмешательство ( 55 ).
Легкие
 Поражение легких наблюдается более чем у 90% пациентов с ГПА в ходе заболевания и варьируется от бессимптомных кавитирующих гранулематозных поражений, которые проявляются в виде множественных легочных узелков или паренхиматозных полос, до легочных инфильтратов и молниеносного альвеолярного кровотечения.
Поражение легких наблюдается более чем у 90% пациентов с ГПА в ходе заболевания и варьируется от бессимптомных кавитирующих гранулематозных поражений, которые проявляются в виде множественных легочных узелков или паренхиматозных полос, до легочных инфильтратов и молниеносного альвеолярного кровотечения.( 54 , 57 ) ( Рис. 19 ). Симптомы, связанные с поражением легких, включают кашель, боль в груди, одышку и кровохарканье ( 42 ).

Рентгенограммы грудной клетки в сочетании с КТ-снимками грудной клетки показывают отклонения в ходе заболевания у 85% пациентов с ГПА, тогда как КТ имеет более высокую чувствительность в обнаружении легочных узелков, полостей и альвеолярных затемнений ( 4 ). Наиболее распространенными результатами визуализации, встречающимися у 40%–70% пациентов, являются легочные узелки и массы, которые обычно множественные, двусторонние и случайные, округлые или овальные, и имеют диаметр от нескольких миллиметров до 10 см ( рис. 20A ). Когда эти поражения больше 2 см, в 25% случаев возникает кавитация ( 57 , 58 ). Стенки полостей могут быть тонкими или толстыми и узловатыми ( рис. 20B ), а кровоизлияние вокруг узелков проявляется на КТ-снимках с высоким разрешением в виде матово-стеклянной непрозрачности, окружающей консолидированный узел, называемой признаком «гало» ( рис. 20C ) ( 58 ). Признак «обратного гало» или «атолла» отражает организующуюся реакцию пневмонии на периферии очагового кровоизлияния ( 59 ). Кроме того, часто может наблюдаться признак питающего сосуда (т. е. сосудов, направляющихся к узелковым поражениям), предполагающий ангиоцентрическое распределение ( рис. 20D ) ( 60 ). Дополнительные результаты включают радиальное линейное рубцевание, плевральные наросты, консолидацию, увеличение бронховаскулярных линий, вовлекающих паренхиму легких, утолщение бронхиальной стенки в сегментарных или субсегментарных бронхах и реже плевральное заболевание, медиастинальную или гилярную лимфаденопатию и интерстициальное заболевание ( 55 , 61 ). Субплевральная и клиновидная, очаговая паренхиматозная или перибронхоартериальная консолидация может отражать гранулематозные изменения и пневмонию ( рис. 21A ) ( 57 ). Пятнистая двусторонняя консолидация воздушного пространства и матово-стеклянные помутнения наблюдаются в 25–50% случаев, более выражены в перихилярных областях, а также в средней и нижней зонах легких и представляют собой диффузное альвеолярное кровотечение из-за некротизирующего капиллярита ( рис. 21B ) ( 61 ). Поражение легочных артериол проявляется мозаичным затуханием или картиной «дерево в почках» ( 62). Легочные узелки и массы, матово-стеклянные затемнения и уплотнения могут усиливаться и ослабевать независимо от применяемой терапии ( 59 ).


Гистопатологический анализ выявляет большие области паренхиматозного некроза в виде нейтрофильных микроабсцессов или большую зону географического некроза, гранулематозного воспаления и васкулита со смешанной клеточной инфильтрацией нейтрофилов, лимфоцитов, плазматических клеток, гистиоцитов и эозинофилов ( рис. 22 ) ( 60 , 61 ).

Поражение сердечно-сосудистой системы и аорты
Поражение сердца наблюдается у 6–30 % пациентов с ГПА; оно проявляется перикардитом, перикардиальным выпотом, панкардитом, очаговым миокардитом, неинфекционным эндокардитом, кардиомиопатией, коронарным васкулитом, который может вызвать ишемию миокарда, гранулемами на клапанах, которые могут вызвать недостаточность или дефекты проводимости, гранулематозной инфильтрацией и сердечной недостаточностью ( 41 , 57 , 63 , 64 ).
Сообщения о случаях ГПА с поражением крупных сосудов включают случаи периаортита с последующей аневризмой аорты и интрамуральным расслоением стенки. Периаортальное воспаление проявляется болью в животе и, как полагают, является результатом распространения гранулематозной ткани через стенку сосуда, в отличие от гранулематозного воспаления, ограниченного слоями стенки (при артериите Такаясу), или васкулита vasa vasorum (при узелковом полиартериите) ( 59 , 64 ). Основным визуальным признаком ГПА с поражением крупных сосудов при КТ и МРТ является утолщение стенки аорты ( рис. E4 ).
Грудь
Поражение груди при ГПА встречается очень редко, встречается в 2,3% случаев, в основном у женщин. Поражение груди возникает как симптом или на фоне системного заболевания ( 65 ). Клинически оно проявляется как односторонняя или двусторонняя болезненная или безболезненная масса груди; воспаление или изъязвление кожи; и/или выделения из соска ( 66 ). Поражение груди проявляется маммографически как утолщение кожи или трабекулярное утолщение. Биопсию следует проводить для исключения рака груди и других форм аутоиммунного или инфекционного мастита ( 66 ). Гистологический анализ выявляет некротизирующее гранулематозное воспаление с центральным некрозом, васкулитом, многоядерными гигантскими клетками, плазматическими клетками, лимфоцитами, рассеянными нейтрофилами и эозинофилами ( рис. 23 ) ( 65 ).

Живот
Поражение желудочно-кишечного тракта встречается редко; оно обнаруживается при поступлении или возникает в течение заболевания у 10–12 % пациентов ( 63 ). Чаще всего поражается тонкий кишечник. Могут возникать язвы, имитирующие воспалительное заболевание кишечника с кровотечением, а также артериальные микроаневризмы мелких и средних артерий в брыжеечных, печеночных и селезеночных сосудах ( 67 ). Острый живот вследствие перитонита, ишемия кишечника вследствие мезентериального васкулита, инфаркт и перфорация являются редкими проявлениями ( 41 , 63 ). Результаты КТ поражения кишечника включают дилатацию кишечника, очаговое или диффузное утолщение стенки кишечника, аномальное усиление стенки кишечника, гребневидную конфигурацию брыжеечных сосудов, асцит и лимфаденопатию ( 68 ).
Поражение печени при ГПА описано в основном в сериях случаев; оно проявляется повышением уровня печеночных ферментов (холестатический и гепатоцеллюлярный паттерны) и редко васкулитом в портальных пространствах и центролобулярных территориях ( 67 , 69 ).
Поражение селезенки также нечасто при ГПА. Сегментарный инфаркт селезенки может быть следствием диффузного артериита, приводящего к окклюзии дистальных паренхиматозных артерий селезенки. Результаты КТ включают периферическую клиновидную область низкой аттенуации, а также субкапсулярную или диффузную гипоаттенуацию в более крупных инфарктах ( 57 ). Поражение поджелудочной железы было зарегистрировано в 11% случаев аутопсий; проявления включают рецидивирующий острый панкреатит и псевдоопухолевые массы поджелудочной железы. Холецистит и инфаркт желчного пузыря встречаются редко ( 67 ).
Почечные и мочеполовые органы
Поражение почек наблюдается у 25–75% пациентов с ГПА, обычно в виде некротизирующего гломерулонефрита, и его наличие предвещает более тяжелый исход ( 11 ). Классическим проявлением поражения почек является быстро прогрессирующий гломерулонефрит с гематурией, протеинурией, отеками, снижением диуреза и быстрым прогрессирующим ухудшением функции почек ( 70 ). Несмотря на лечение, у 20–30% пациентов с васкулитом, связанным с АНЦА, с поражением почек в течение 5 лет разовьется терминальная стадия почечной недостаточности, а те, кому перенесли трансплантацию почки, демонстрируют схожую 10-летнюю выживаемость пациентов и трансплантатов по сравнению с соответствующими контрольными группами с другими причинами почечной недостаточности ( 71 ).
Визуализация может быть полезна для дифференциации васкулита сосудов среднего размера (т. е. узелкового полиартериита) от васкулита мелких сосудов, вовлекающего почки, и может использоваться для оценки сосудистых осложнений и мониторинга ответа на лечение. Например, УЗИ почек может использоваться для оценки размера и контура почек и, следовательно, дает информацию о хроничности заболевания ( 72 ) ( рис. E5 ). Гистологическая оценка выявляет малоиммунный некротизирующий серповидный гломерулонефрит ( рис. 24 ) ( 42 ). Интерстициальные гранулемы встречаются редко, с частотой от 5% до 12%. Наличие интерстициальных гранулем в сочетании с малоиммунным серповидным гломерулонефритом настоятельно предполагает диагноз ГПА ( 70 ).

Нижняя часть мочеполовой системы редко встречается при ГПА. Это происходит в 0,7–7,4% случаев и может поражать любую часть мочеполового тракта, включая простату, семенные пузырьки, придатки яичек, яички (орхит, эмболический инфаркт яичек, вторичный по отношению к небактериальному тромботическому эндокардиту, и инфаркт яичек), половой член, уретру, мочеточники, шейку матки, влагалище, брюшину и забрюшинное пространство ( 73 ). Среди этих органов простата является наиболее частым местом с проявлениями учащенного мочеиспускания, дизурии и макроскопической гематурии с твердой, увеличенной, уплотненной простатой ( 73 ). Визуализационные исследования выявляют увеличенную простату, имитирующую абсцесс, тогда как гистологические данные включают экстраваскулярные гранулемы, фибриноидный некроз и воспалительный инфильтрат, состоящий из лимфоцитов, гистиоцитов и нейтрофилов ( 74 ) ( рис. 25 ).

Конечности
Поражение периферической нервной системы наблюдается у 67% пациентов с ГПА, проявляясь в виде сенсомоторной полинейропатии (55%) или множественного мононеврита (45%). Это происходит особенно часто в течение первых 2 лет от начала заболевания, у мужчин пожилого возраста и на фоне других клинических проявлений ( 15 ). С другой стороны, поражение кожи наблюдается у 10%–50% пациентов, причем наиболее распространенным поражением является пальпируемая пурпура (особенно на нижних конечностях, с гистопатологическим признаком лейкоцитокластического васкулита с фибриноидным некрозом). Также могут наблюдаться папулы, подкожные узелки, везикулы, волдыри, некротически-язвенные поражения и сетчатое ливедо, тогда как гангрена пальцев и язвы, похожие на гангренозную пиодермию, встречаются реже ( 75 ).
Заключение
Гетерогенные проявления ГПА представляют собой значительную проблему в диагностике этого редкого заболевания. Распознавая общие и необычные результаты визуализации ГПА, радиологи играют важную роль в диагностике и наблюдении пациентов с ГПА и помогают врачам различать активность заболевания и повреждение, что в конечном итоге влияет на терапевтические решения.