Долгосрочные нарушения легких, связанные с пневмонией, вызванной COVID-19
На третьем году пандемии SARS-CoV-2 многое стало известно о долгосрочном влиянии пневмонии, вызванной COVID-19, на легкие. Примерно у трети пациентов с пневмонией средней и тяжелой степени, особенно тех, кто нуждается в интенсивной терапии или искусственной вентиляции легких, через 1 год после обращения наблюдаются остаточные отклонения при КТ грудной клетки. Аномалии варьируются от паренхиматозных тяжей до расширения бронхов и выраженного фиброза. Меньше известно о долгосрочных легочных сосудистых последствиях, но, по-видимому, существует постоянный повышенный риск венотромбоэмболических осложнений у небольшой группы пациентов. Наконец, связанные с этим гистологические отклонения, возникающие в результате инфекции SARS-CoV-2, аналогичны тем, которые наблюдаются у пациентов с другими причинами острого повреждения легких.
Краткое содержание
У некоторых пациентов с COVID-19 от умеренной до тяжелой степени наблюдаются отклонения на КТ грудной клетки, которые сохраняются в течение по крайней мере года после заражения и могут сопровождаться симптомами; эти аномалии КТ имеют сходство с теми, которые были описаны во время эпидемии тяжелого острого респираторного синдрома в 2002–2003 гг.
Основы
-
■ Примерно у трети пациентов, госпитализированных с пневмонией, вызванной COVID-19, через 12 месяцев после заражения на КТ грудной клетки наблюдались отклонения от нормы.
-
■ Нарушения КТ варьировались от остаточных паренхиматозных тяжей до фиброза, а также воздушных ловушек и бронхоэктазов.
-
■ У очень небольшого числа пациентов после острой инфекции наблюдался устойчиво повышенный риск развития венотромбоэмболических заболеваний.
-
■ Гистопатологические данные при поздних стадиях заболевания COVID-19 были аналогичны таковым при других причинах острого повреждения легких, со смесью гистологических паттернов организующейся и хронической фиброза, и были сопоставимы с данными, полученными при эпидемии тяжелого острого респираторного синдрома.
Введение
На третьем году пандемии SARS-CoV-2 и после последней волны варианта Омикрон в начале 2022 года большая часть мира перешла к эндемическому способу борьбы с Covid-19, хотя и неофициально, как сообщает Всемирное здравоохранение. На момент написания этой статьи организация не объявила о завершении пандемии. Вакцины легко доступны во многих странах, и большая часть населения мира, по-видимому, имеет некоторую степень иммунитета от вакцинации, перенесенной инфекции или того и другого. В отличие от SARS-CoV-1, о котором не сообщалось среди населения с середины 2003 года ( 1 ), SARS-CoV-2, похоже, не исчезает до полного исчезновения. Было показано, что даже более новые варианты SARS-CoV-2 избегают нейтрализующих антител от предыдущего заражения и вакцинации ( 2 ), что способствует новым инфекциям и повторным инфекциям во всем мире.
Поскольку число людей, перенесших один или несколько эпизодов COVID-19, быстро растет, увеличивается доля населения с долговременными симптомами и хроническими проявлениями заболевания в легких. Состояния после COVID-19, также называемые «длительным COVID», «длительным COVID» или «постострыми последствиями COVID-19», состоят из длинного списка признаков и симптомов, начиная от одышки до депрессия и нарушение сна ( 3–5 ) , которые , как сообщается , встречаются у 10% пациентов ( 6–8 ). Хотя не существует общепризнанных определений, в рекомендациях Британского медицинского журнала «длительный COVID» определяется как стойкие симптомы после 4 недель, а «пост-COVID-синдром» — как симптомы, продолжающиеся более 12 недель ( 3 ). Поскольку причины стойких симптомов, вероятно, многофакторны и в настоящее время недостаточно изучены, растущая радиологическая литература о хронических заболеваниях легких при COVID-19 может в конечном итоге облегчить понимание долгосрочных респираторных проблем и корреляций с визуализацией у пострадавших людей.
Знание типичных долгосрочных последствий пневмонии COVID-19 при визуализации органов грудной клетки важно для оценки потенциальных причин хронических респираторных симптомов у выживших, оценки улучшения при последующей визуализации и дифференциации ожидаемых результатов после COVID-19 от других заболеваний легких. . В этой статье обобщены текущие знания о паренхиматозных изменениях паренхимы легких, дыхательных путях, легочных сосудах и гистопатологических данных после COVID-19.
Аномалии паренхимы легких
Острые и подострые результаты КТ паренхимы легких при пневмонии, вызванной COVID-19, хорошо описаны и обобщены в Таблице 1 . Эти паттерны поражения легких аналогичны таковым при инфекции SARS-CoV-1 ( 9 , 10 ) и гриппе с гемагглютинином 1-го типа и нейраминидазой 1-го типа (H1N1) ( 11 , 12 ).
 |
В нескольких проспективных обсервационных исследованиях оценивались долгосрочные изменения на КТ грудной клетки у пациентов с пневмонией, вызванной COVID-19, примерно через 12 месяцев после заболевания ( 13–27 ) . Однако эти исследования ограничены небольшими когортами с самой различной степенью тяжести заболевания. Еще больше усложняют ситуацию различия в парадигмах последующего наблюдения и методах оценки КТ.
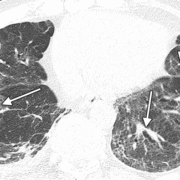
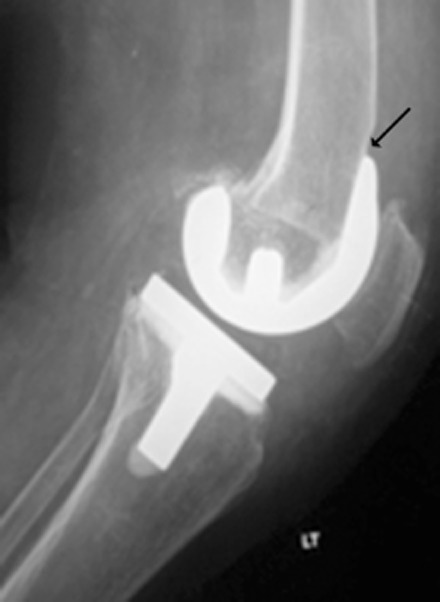
К счастью, недавний систематический обзор и метаанализ, проведенный Ватанабэ и др. ( 28 ), позволяют лучше понять наблюдаемые результаты КТ грудной клетки примерно через 12 месяцев после пневмонии, вызванной COVID-19. Авторы объединили данные из 15 обсервационных ( 21 ) исследований, предоставив данные о 3134 людях. Следует отметить, что популяции, участвовавшие в этих исследованиях, были неоднородными (статистика гетерогенности I2 = 93%): 11 исследований проводились в Китае, три – в Италии и одно – в Великобритании. В общей группе из 3134 пациентов 1801 пациенту была выполнена компьютерная томография через 12 месяцев. Двенадцать из 15 исследований предоставили данные о доле пациентов с остаточными аномалиями легких при КТ, которая оценивается в 33%. Наиболее распространенными проявлениями были помутнение по типу «матового стекла» и «фиброзоподобные изменения» (21% для обоих), за ними следовали бронхоэктазы у 10%, утолщение междольковой перегородки у 8%, ретикулярное помутнение у 6% и консолидация у 3% пациентов. . «Фиброподобные изменения» различались в разных исследованиях и включали «архитектурные искажения с тракционными бронхоэктазами, сотовыми образованиями или и тем, и другим» ( рис . 1–3 ) ( 15 ), «тракционные бронхоэктазы/бронхиоэктазы, потерю объема или то и другое» ( 26 ), « признаки полосообразного фиброза, но не сетчатого помутнения» ( 21 ), а также «наличие сотовых, сетчатых и тракционных бронхоэктазов» ( 27 ).



В двенадцати из 15 исследований сообщалось о доле аномальных результатов КТ грудной клетки через 12 месяцев в зависимости от тяжести COVID-19. В этот субанализ были включены 85% (950 из 1112) пациентов с тяжелой и критической формой COVID-19 и 87% (560 из 641) с легкой и среднетяжелой формой COVID-19. В группе от тяжелой до критической у 38% (278 из 816) пациентов были остаточные КТ-аномалии, включая помутнение по типу «матового стекла», «фиброзоподобные изменения», бронхоэктазы и утолщение междольковой перегородки. В группе легкой и средней степени тяжести у 24% (91 из 378) пациентов были остаточные результаты КТ, состоящие в основном из помутнения по типу «матового стекла». Результаты этого систематического обзора и метаанализа аналогичны опубликованным в 2003 году результатам эпидемии SARS-CoV-1, которые показали, что у 30–40% выживших после тяжелого острого респираторного синдрома наблюдались радиологические отклонения через 6–12 месяцев после выздоровления. Те, у кого были остаточные отклонения через 12 месяцев, имели аналогичные результаты 15 лет спустя ( 29 , 30 ).
Полному пониманию долгосрочных результатов КТ грудной клетки при COVID-19 мешают многочисленные предубеждения и недостатки в этих продольных обсервационных исследованиях. Поскольку многие исследования сосредоточены на результатах КТ грудной клетки с течением времени, неудивительно, что когорты исследования отдают предпочтение пациентам с более тяжелым заболеванием, поскольку они с большей вероятностью будут проходить КТ грудной клетки на момент постановки диагноза, а пациенты с легкими остаточными отклонениями или без них могут не иметь прошел дополнительную визуализацию. Пациенты во многих из этих исследований с большей вероятностью были госпитализированы и нуждались в госпитализации в отделение интенсивной терапии и искусственной вентиляции легких.
Еще одна проблема заключается в том, что в этих исследованиях в основном участвуют пациенты, заразившиеся COVID-19 на ранней стадии пандемии. Вирус со временем эволюционировал в более поздний, более заразный вариант Омикрона (линии BA.1, BA.1.1, BA.2, BA.3, BA.4 и BA.5), который связан с более легким заболеванием, чем начальный вариант и более тяжелый вариант Дельта (линии B.1.617.2 и AY). Недавнее исследование 106 госпитализированных пациентов с COVID-19, 40 с вариантом Омикрона (более ранней линии) и 66 с вариантом Дельта, показало более низкие показатели тяжести КТ в когорте с вариантом Омикрона (31 ) . Yoon и соавт. ( 32 ) ретроспективно проанализировали компьютерную томографию 176 госпитализированных пациентов, 88 с вариантом Дельта и 88 с вариантом Омикрон ранней линии. Пациенты с вариантом Омикрон имели менее тяжелую степень заболевания и более перибронхиальное распространение (а не периферическое), чем пациенты, инфицированные вариантом Дельта.
Определение «фиброза» при КТ грудной клетки, используемое в этих исследованиях, также проблематично. Как подчеркивается в систематическом обзоре и метаанализе Watanabe et al ( 28 ), определение «фиброзоподобных нарушений», используемое в некоторых исследованиях, различалось. Поскольку тканевое подтверждение фиброза не было получено (что вполне логично), наличие фиброза предполагалось только на основании результатов КТ. Еще одним потенциальным препятствием является то, что пациенты с остаточными интерстициальными аномалиями легких при последующих компьютерных томограммах могли иметь эти аномалии до пневмонии, вызванной COVID-19. Сообщается, что эти отклонения наблюдаются у 10% населения, особенно у пожилых людей, которые составляют большинство пациентов с более тяжелой пневмонией, вызванной COVID-19 (33 ) .
Влияние на дыхательные пути
У выживших после пневмонии, вызванной COVID-19, можно наблюдать большие и малые аномалии дыхательных путей, причем частота и тяжесть коррелируют с тяжестью острого заболевания. Результаты КТ дыхательных путей в острой и подострой форме пневмонии, вызванной COVID-19, обобщены в Таблице 2 . Результаты небольших заболеваний дыхательных путей, такие как мозаичное затухание и воздушные ловушки, наблюдались при парной КТ вдоха и выдоха, а исследования МРТ с гиперполяризованным ксеноном 129 (129 Xe ) показывают аномальные паттерны вентиляции и перфузии у пациентов с длительным течением COVID-19. респираторные симптомы даже при нормальной КТ.
 |
Нарушения дыхательных путей, наблюдаемые в результате предыдущих крупных вспышек респираторных вирусов, служат контекстом для пандемии COVID-19. При птичьем гриппе (H7N9) бронхоэктазы были обычным явлением при КТ через 12 месяцев наблюдения и присутствовали у 24% пациентов (10 из 41), в то время как рестриктивные или обструктивные нарушения функции легких были обнаружены у 55% (11 из 20). ) пациентов, для которых были доступны последующие 12-месячные обследования ( 34 ). Бронхоэктатическая болезнь как долгосрочное последствие инфекции также наблюдалась при ближневосточном респираторном синдроме и SARS-CoV-1 ( 35 ). Задержка воздуха при КТ была описана как частая находка у выживших после пневмонии SARS-CoV-1, обнаруженная у 93% (37 из 40) пациентов при средней продолжительности наблюдения 51,8 дня и у 80% (16 из 20) пациентов. пациентов при средней продолжительности наблюдения 140,7 дней ( 35 ) и у 23% (11 из 47) в другом исследовании 6-месячной КТ у детей с SARS-CoV-1 ( 36 ).
Большие аномалии дыхательных путей
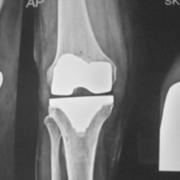
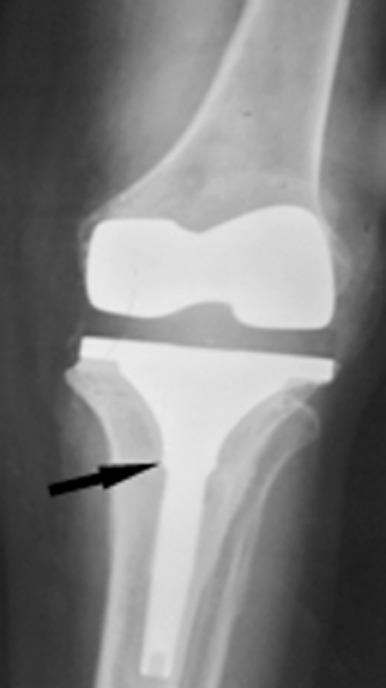
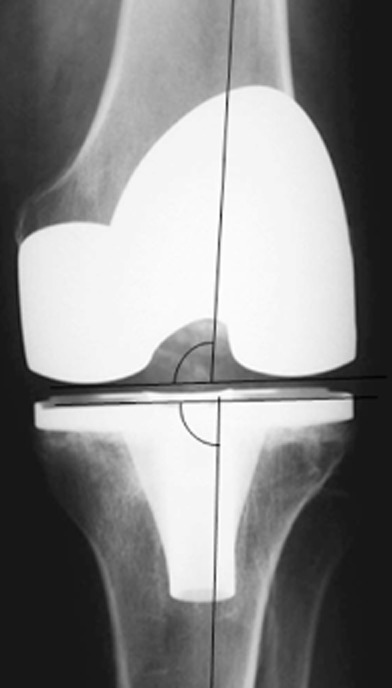
Бронхиальные аномалии, такие как утолщение и расширение стенок, часто встречаются у пациентов с пневмонией, вызванной COVID-19, в острой фазе и на ранней фазе выздоровления, частота и тяжесть которых со временем уменьшаются (37 ) . Расширение бронхов сохраняется у части пациентов после выздоровления от пневмонии, вызванной COVID-19, чаще у пациентов с более тяжелым заболеванием и часто в виде тракционных бронхоэктазов, сопровождающихся другими признаками фиброза. Бронхоэктазы после COVID-19 часто бывают периферическими и связаны с ретикуляционными или лентовидными помутнениями. Besutti и соавт. ( 38 ) обнаружили бронхоэктазы при КТ у 13% (52 из 405) пациентов, проведенных через 5–7 месяцев после выписки по поводу тяжелой пневмонии, вызванной COVID-19. Из них 85% (44 из 52) пациентов имели периферическое распределение, тогда как только 2% (один из 52) имели центральное распределение и 13% (семь из 52) имели как центральное, так и периферическое распределение. Как и при идиопатических интерстициальных пневмониях, тракционные бронхоэктазы могут быть важно распознать из-за корреляции с функциональными нарушениями. В одном исследовании выживших после COVID-19 тракционные бронхоэктазы были обратно связаны с прогнозируемым процентом диффузионной способности легких по угарному газу ( R = -0,49, P < 0,001) и прогнозируемым процентом форсированной жизненной емкости легких ( R = -0,23, P = 0,04) и напрямую коррелировал с показателем по шкале кашля ( R = 0,25, P = 0,03) ( 39 ).
Хотя тракционные бронхоэктазы, связанные с фиброзом, могут быть важным хроническим признаком у выживших после COVID-19, существующие исследования часто не позволяют отличить тракционные бронхоэктазы (предполагающие признаки фиброза) от бронхоэктазов в широком понимании, которые могут быть вызваны любым повреждением дыхательных путей (рис. 4–6 ) . ). Например, в проспективном исследовании компьютерной томографии пациентов через 6 месяцев после выписки из-за умеренной или тяжелой пневмонии, вызванной COVID-19, Карузо и др. (40 ) сообщили о «фиброзоподобных изменениях», определяемых как «сетчатые и/или сотовые структуры» в 72% случаев (40). 85 из 118) больных, бронхоэктатическая болезнь – у 25% (29 из 118); о проценте больных с тракционными бронхоэктазами не сообщалось. Метаанализ Watanabe et al ( 28 ) также включает исследования, в которых частота тракционных бронхоэктазов и других типов бронхоэктазов неясна. Эти потенциально перекрывающиеся категории затрудняют определение того, является ли бронхоэктатическая болезнь у выживших после COVID-19 первичным признаком фиброза (тракционные бронхоэктазы), повреждения дыхательных путей в результате вирусной инфекции или баротравмы или какой-либо комбинации этих этиологий.



Бронхоэктатическая болезнь уже давно признана частым признаком острого респираторного дистресс-синдрома (ОРДС), вызванного другими заболеваниями, кроме COVID-19. Считается, что бронхоэктазы, связанные с ОРДС, наиболее распространенные в передних отделах легких и сопровождающиеся сетчатыми и архитектурными искажениями, являются результатом баротравмы в условиях искусственной вентиляции легких, тяжесть которой коррелирует с продолжительностью вентиляции и высоким давлением на вдохе (41 , 42 ) . . Из 7% (28 из 405) пациентов с фиброзными аномалиями в исследовании выживших после тяжелой пневмонии, вызванной COVID-19, у 36% (10 из 28) наблюдался «поствентиляционный фиброз», определяемый как преобладание передних субплевральных кистозных пространств и ретикуляции. и у 90% (девять из 10) из них были тракционные бронхоэктазы ( 38 ). Тракционные бронхоэктазы могут быть обусловлены прежде всего ОРДС и искусственной вентиляцией легких. В одном исследовании пациентов, госпитализированных с пневмонией средней степени тяжести, вызванной COVID-19, из которого были исключены пациенты с ОРДС, искусственной вентиляцией легких или и тем, и другим, были обнаружены бронхоэктазы или бронхоэктазы на компьютерной томографии через 3 и 12 месяцев только у 2% (двух из 84) пациентов, в то время как «тракционные бронхоэктазы» /бронхиоэктаз» как признак фиброза не был выявлен на компьютерной томографии ни у одного пациента через 3 месяца и развился только у 2% (двух из 84) пациентов через 12 месяцев (43 ) .
Расширение бронхов может быть полностью обратимым, даже при пневмонии, вызванной COVID-19, осложненной ОРДС, что подчеркивает необходимость осторожности при интерпретации острого или подострого расширения бронхов как признака паренхиматозного фиброза или длительного повреждения дыхательных путей. В исследовании 41 человека, выжившего после пневмонии, вызванной COVID-19, с ОРДС, Ху и др. ( 44 ) сравнили компьютерную томографию, полученную через 1–4 недели после появления симптомов, с результатами, полученными по крайней мере через 4 месяца после заражения. У 28 из 41 пациента (68%) развилось варикоидное расширение бронхов («тракционные бронхоэктазы») в пределах паренхиматозных помутнений в течение 1-го месяца, которое разрешилось у большинства (21 из 28, 75%) и значительно улучшилось в остальных случаях. семь пациентов (17% выборки исследования). В исследовании пациентов, госпитализированных по поводу COVID-19, Пан и др. ( 13 ) обнаружили расширение бронхов при КТ, выполненной при выписке, у 27% (57 из 209) пациентов и через 12 месяцев после появления симптомов у 11% (24 из 209). , с разрешением бронхиальной дилатации у 33 пациентов. Luger и соавт. ( 45 ) обнаружили расширение бронхов у 11% (восемь из 76) пациентов с легкой и тяжелой пневмонией, вызванной COVID-19, на исходном уровне и у 9% (восемь из 91) при КТ через 12 месяцев наблюдения.
Небольшие аномалии дыхательных путей
В недавних исследованиях использовалась парная компьютерная томография вдоха и выдоха для оценки возможного вклада заболеваний мелких дыхательных путей в стойкие симптомы при длительном течении COVID-19. Захват воздуха определяется как наличие долек или областей с меньшим, чем обычно, увеличением затухания и отсутствием уменьшения объема при КТ в конце выдоха ( 46 ). Хотя обструктивный дефицит при спирометрии встречается гораздо реже, чем ограничения диффузионной способности (диффузионная способность легких по монооксиду углерода) у выживших после COVID-19, у некоторых пациентов при тестировании функции легких обнаруживаются признаки небольшого поражения дыхательных путей, а при КТ может наблюдаться задержка воздуха. сигнализировать о заболевании мелких дыхательных путей ниже порога обнаружения с помощью функциональных тестов легких ( 19 , 37 ).
Задержание воздуха является частым явлением при острых респираторных инфекциях и было зарегистрировано при COVID-19 ( 47 ). В нескольких исследованиях также сообщалось, что образование воздушных ловушек является долгосрочным явлением у выживших после Covid-19. В исследовании 205 пациентов, ранее госпитализированных по поводу пневмонии, вызванной COVID-19, воздушные ловушки наблюдались при КТ выдоха у 29%, при этом количественные показатели захвата воздуха в группе тяжелой пневмонии были значительно выше, чем в группе легкой пневмонии (48 ) . В дополнительных исследованиях изучалась частота возникновения воздушных ловушек при КТ у пациентов с симптомами, длительно страдающих COVID-19. Франке и соавт. ( 37 ) использовали парную КТ вдоха и выдоха для оценки пациентов с персистирующими респираторными симптомами по крайней мере через 30 дней после появления симптомов COVID-19 (в среднем 72,5 дня). Захват воздуха был наиболее распространенной патологией (37 из 48 пациентов, 77%) ( рис. 7 ), более распространенной, чем такие явления, как помутнение по типу «матового стекла» (19 из 48 пациентов, 40%), ретикуляция (18 из 48 пациентов, 38%) ) или тракционные бронхоэктазы (девять из 48 пациентов, 19%). Кроме того, задержка воздуха чаще наблюдалась у пациентов мужского пола и увеличивалась с возрастом. В проспективном исследовании пациентов с постострыми последствиями COVID-19, у которых симптомы сохранялись в течение как минимум 30 дней после постановки диагноза, Cho et al (49) выявили воздушные ловушки при качественном осмотре у 58% (50 из 86) пациентов. Авторы также использовали количественную КТ с контролируемым методом машинного обучения для оценки процента захвата воздуха в легких, обнаружив схожие средние значения для пациентов, получавших лечение в амбулаторных условиях (25%), госпитализированных пациентов (25%) и пациентов, которым требовалось отделение интенсивной терапии (27%). Однако у пациентов с COVID-19 средний показатель задержки воздуха был значительно выше, чем у здоровых людей из контрольной группы (7%, P < 0,001).

Неясно, является ли задержка воздуха проявлением обратимого воспаления дыхательных путей, первичного повреждения дыхательных путей вследствие COVID-19, постинфекционного облитерирующего бронхиолита, последствия диффузного альвеолярного повреждения (ДАП) или какого-либо другого процесса. Исследования воздушных ловушек у выживших после Covid-19 были ограничены из-за отсутствия сравнительных компьютерных исследований до начала инфекции, что не позволяло исключить ранее существовавшие заболевания мелких дыхательных путей. Кроме того, было хорошо задокументировано наличие воздушных ловушек как частого явления у бессимптомных лиц без признаков поражения мелких дыхательных путей ( 50 ).
Гиперполяризованная МРТ с 129 Xe также недавно появилась как метод исследования гетерогенности вентиляции и газообмена у пациентов с длительными симптомами COVID-19, такими как одышка. Гиперполяризованный газ 129 Xe быстро диффундирует через альвеолярные мембраны в эритроциты, позволяя реконструировать газ, ткани и плазму, а также получать изображения фаз эритроцитов, которые отображают региональную вентиляцию и легочную перфузию (51 ) . В исследовании 76 выживших после COVID-19 (в среднем через 13,8 недель после положительного индекса теста на COVID-19) с персистирующими респираторными симптомами и девяти здоровых добровольцев, не перенесших COVID-19 в анамнезе, Кунер и др. (52) обнаружили значительно большее среднее значение . процент дефектов вентиляции у 23 пациентов, ранее госпитализированных с COVID-19 (8%), чем у 53 пациентов без госпитализации (4%); в обеих группах процент нарушений вентиляции был значительно выше, чем у здоровых добровольцев (1%). В том же исследовании было выявлено аномальное соотношение остаточного объема к общей емкости легких у 14 из 38 пациентов (37%), у которых оно было измерено, что позволяет предположить, что причиной является небольшая обструкция дыхательных путей. Тем не менее, другие исследования МРТ с гиперполяризацией 129 Xe обнаружили относительно нормальную вентиляцию, измеренную в газовой фазе, со значительным дефицитом газообмена, о чем свидетельствуют аномальные изображения фазы эритроцитов, и значительно сниженным соотношением эритроцитов к тканевой плазме, маркером газовой фазы. диффузия через альвеолярный эпителий ( 51 , 53 ). Относительный вклад заболеваний мелких дыхательных путей и заболеваний альвеолярных сосудов еще предстоит определить и может варьироваться у разных людей и в зависимости от клинических обстоятельств.
Легочные сосудистые нарушения
Наличие легочных сосудистых аномалий было выявлено в начале пандемии COVID-19. Расширение легочной сосудистой сети в зонах пневмонии было описано в начальной серии случаев ( 54 , 55 ). Вскоре после этого был отмечен повышенный риск легочной эмболии и тромбоза легочных артерий in situ, особенно у пациентов с тяжелым течением заболевания. За последующие 3 года пандемии спектр выявленных заболеваний легочных сосудов, связанных с COVID-19, значительно расширился, что повлияло на текущую медицинскую практику.
В этом разделе мы рассмотрим современные данные и идеи относительно долгосрочных легочных сосудистых проявлений инфекции SARS-CoV-2, уделив особое внимание легочным сосудистым заболеваниям при «длительном COVID». Динамика данных, касающихся заболеваний легочных сосудов при остром течении COVID-19, обобщена в Таблице 3 . Общей нитью является эндотелиит легких ( 56–58 ), который является важным признаком острого заболевания COVID-19 и может сохраняться в период выздоровления в течение неопределенной продолжительности .
 |
«Длительный COVID» включает в себя различные состояния, включая тромбоэмболию легочной артерии (ЛЭ), которая, по-видимому, чаще встречается среди людей, которым ранее был поставлен диагноз COVID-19. Булл-Оттерсон и др. ( 59 ) в ретроспективном групповом исследовании взрослых на основе национального набора данных электронных медицинских карт, насчитывающего более 63 миллионов записей (март 2020 г. – ноябрь 2021 г.), наблюдали за когортами в течение 30–365 дней после встречи с индексом. для 26 инцидентов, описанных как связанные с «длительным COVID». Исследуемые когорты из 353 164 пациентов с COVID-19 и 1 640 776 без COVID-19 были стратифицированы по возрасту. В когорте с COVID-19 было значительно больше происшествий по сравнению с когортой без Covid-19: 38% (35,4% для возрастной группы 18–64 лет, 45,4% для возрастной группы 65 лет и старше) против 16% (14,6% для возрастной группы 18 лет). –64 года, 18,5% для 65 лет и старше). Самый высокий коэффициент риска был для ПЭ: 2,1 и 2,2 для младшего и старшего возраста соответственно.
Риск «длительного COVID» для пациентов с прорывными инфекциями был изучен Аль-Али и др. ( 60 ) в ретроспективном когортном исследовании из базы данных по делам ветеранов. Лиц с прорывным течением COVID-19 исследовали на предмет различных инцидентов, которые, как было описано, связаны с «длительным COVID», а также на предмет смертности. Группу революционного COVID-19 сравнивали с современной, исторической и непривитой контрольной группой, а также с пациентами с сезонным гриппом. В период от 30 дней до 6 месяцев после прорывной инфекции COVID-19 у пациентов наблюдался повышенный риск (отношение рисков [ОР], 1,5) для постострых состояний COVID-19 с самым высоким риском ТЭЛА (ОР, примерно 4). Этот риск был самым большим для пациентов, нуждающихся в отделении интенсивной терапии, по сравнению со стационарными и амбулаторными пациентами, как в целом, так и при ТЭЛА. Пациенты с прорывным течением COVID-19 также имели более высокий риск смерти (ОР 1,75); однако по сравнению с невакцинированными пациентами с COVID-19 у этих пациентов был меньший риск (ОР «длительного COVID», 0,85; ОР смерти, 0,66). Когда пациентов, госпитализированных с гриппом, сравнивали с пациентами, госпитализированными с прорывным Covid-19, пациенты с COVID-19 имели более высокий риск состояний, связанных с длительным течением COVID-19 (ОР, 1,27) и смерти (ОР, 2,43).
Важно различать чрезвычайно редкие тромботические нежелательные явления, связанные с вакцинацией, включая ТЭЛА и ЛЭ, связанную с COVID-19, прорывной COVID-19 и долгосрочный COVID-19. Вакцино-индуцированная иммунная тромботическая тромбоцитопеническая пурпура (ВИТТ) вызвана выработкой антител к полианионным комплексам фактора тромбоцитов 4 и зарегистрирована для всех четырех основных вакцин против SARS-CoV-2, недавно использовавшихся (Pfizer, Moderna, Johnson & Johnson). и AstraZeneca), а чаще всего — ChADOx1 nCoV-19 (AstraZeneca) ( 61–64 ) . Симптомы обычно развиваются в течение 4 недель после первоначальной вакцинации. Выявление VITT имеет ключевые терапевтические последствия, поскольку избегают применения гепарина из-за аналогичного механизма иммуноопосредованной гепарин-индуцированной тромбоцитопении.
Отдаленные легочные сосудистые проявления COVID-19 остаются до конца не изученными. Текущий консенсус отдает предпочтение эндотелииту ( 56 , 65 , 66 ) и распространению воспалительного процесса в легких ( 67 ), а не васкулиту, как доминирующему объяснению широкомасштабных нарушений легочных сосудов, связанных с COVID-19. К ним относятся стойко повышенный риск ТЭЛА и, возможно, развитие хронической тромбоэмболической легочной гипертензии ( 68 ) и легочной гипертензии ( 69 ). Иногда сообщалось о различных интригующих, но редко описываемых аномалиях легочных сосудов, связанных с COVID-19, значение которых неясно. Брито-Азеведо и др. ( 70 ) описали внутрилегочную сосудистую дилатацию с установкой шунта при эхокардиографии у небольшой группы пациентов, которым потребовалось отделение интенсивной терапии, и авторы предположили, что это может, по крайней мере частично, быть причиной гипоксемии, связанной с COVID-19. и расширенные сосуды на КТ, по механизму сходному с гепатопульмональным синдромом.
Дхаван и др. ( 71 ) предложили использовать вентиляционно-перфузионную (V/Q) сцинтиграфию легких, предпочтительно с ОФЭКТ, в качестве визуализирующего теста первой линии для оценки остаточных тромбов и заболеваний мелких легочных сосудов у пациентов, которые выздоровели от COVID-19, но все еще имеют стойкие респираторные симптомы. Их обоснование заключается в том, что сканирование V/Q играет ведущую роль в оценке заболеваний мелких сосудов легких, которые могут быть неоптимально продемонстрированы на КТ-ангиографах легких. Авторы выделили ожидаемые закономерности заболеваний мелких сосудов в дополнение к ТЭЛА и паренхиматозным заболеваниям легких и предположили, что V/Q-сканирование должно играть клиническую и исследовательскую роль в выяснении эволюции сосудистых заболеваний после острого заболевания COVID-19. Наряду с V/Q-сканированием, продольные данные спектральной КТ должны продолжать проливать свет на долгосрочные легочные сосудистые последствия COVID-19 ( 72 ).
Патологические находки при долгосрочном COVID-19
По мере развития пандемии COVID-19 постепенно стали проявляться патологические изменения в легких, связанные с инфекцией SARS-CoV-2. Некоторые из самых первых сообщений о гистопатологических изменениях при пневмонии, вызванной COVID-19, у живых пациентов были получены из Уханя, Китай, где у пациентов, перенесших операцию по поводу рака легких, также был обнаружен COVID-19 (73 ) . Неудивительно, что в этих ранних сообщениях описывались изменения при остром или раннем формирующемся DAD или других формах острого повреждения легких. Сейчас, на третьем году пандемии, появилась более четкая картина гистопатологических изменений, связанных с COVID-19.
SARS-CoV-2 инфицирует клетки дыхательных путей человека путем связывания с рецептором ангиотензинпревращающего фермента 2 (ACE2) ( 74 ). В остром периоде у пациентов с SARS-CoV-2 и дыхательной недостаточностью обычно наблюдаются гистопатологические признаки DAD. Сообщалось о других формах острого повреждения легких, включая организующуюся пневмонию, острую фибринозную и организующуюся пневмонию, но они встречаются реже, чем DAD. Гистопатологические особенности и патофизиологические механизмы острой пневмонии , вызванной COVID-19, выходят за рамки данного обзора и хорошо описаны ( 75–82 ). Некоторые авторы придерживаются мнения, что патологоанатомические проявления острого COVID-19 аналогичны таковым при других формах острого повреждения легких ( 83 , 84 ), но другие предполагают, что некоторые данные чаще встречаются у пациентов с острым повреждением легких, вторичным по отношению к COVID-19. 19. Хотя легочные микротромбы часто наблюдаются как компонент DAD любой причины, они часто упоминаются как частая находка при остром COVID-19 или встречаются чаще, чем другие вирусные пневмонии (77 , 85–87 ) . Были описаны и другие сосудистые поражения, в том числе старые реканализованные тромбы, сосудистый застой и гемангиоматозоподобные поражения ( рис. 8 , 9 ), в областях без признаков острого повреждения легких ( 88 ). Хотя точные патофизиологические механизмы все еще обсуждаются, эти результаты предполагают возможность наличия отчетливого сосудистого фенотипа повреждения легких, возникающего у пациентов с COVID-19.


У пациента с ДАД, вторичным по отношению к COVID-19 или другой причине, обычно проходит острая фаза, характеризующаяся образованием гиалиновой мембраны, а затем переходит в организующую фазу с пролиферацией фибробластов ( рис. 10 ) ( 89 ). Существует дихотомия в том, как легкие разрешают ДАД. Хотя у большинства пациентов с DAD наблюдаются некоторые долговременные респираторные симптомы, может наблюдаться постепенное разрешение DAD или DAD может перейти в фиброзную фазу ( 89 , 90 ).

В условиях продолжающейся пандемии у большинства пациентов наблюдается полное исчезновение легочных аномалий без гистологических признаков идентифицируемого заболевания, и маловероятно, что они будут подвергаться дальнейшему обследованию ( 91 ). Теперь известно, что это справедливо не для всех пациентов. Долгосрочные легочные последствия острого COVID-19 могут проявляться в виде организующейся пневмонии через несколько недель после первоначального заражения, которая может спонтанно разрешиться ( 92 ). Некоторые из самых ранних сообщений о гистопатологических изменениях в легких, связанных с фиброзом, у пациентов с тяжелой формой COVID-19 были получены из эксплантированных легких пациентов, перенесших трансплантацию ( 93 , 94 ). Авторы этих исследований выявили диффузный интерстициальный фиброз с равномерным коллагеновым утолщением альвеолярных перегородок. Также были выявлены сотовые изменения, а также кистозные пространства, выстланные гистиоцитами и гигантскими клетками. Некоторые из этих результатов также наблюдались в образце эксплантата легкого в препринтной статье и при вскрытии ( 95 , 96 ). В серии трансбронхиальных биопсий из Бразилии было выявлено утолщение перегородки и ремоделирование дыхательных путей ( 97 ). Помимо ремоделирования дыхательных путей, имеются сообщения о хроническом бронхиолите и перибронхиолярной метаплазии ( 98 , 99 ). Эти вышеупомянутые случаи ( 93 , 94 , 97 ), вероятно, представляют собой фиброзную фазу DAD, которая хорошо описана в исследовании аутопсии в Китае и на небольшой серии эксплантированных легких с очень похожими результатами в Соединенных Штатах (рис. 11 ) ( 98 , 100 ).

Гистопатологическую картину усложняет то, что в другой серии случаев, основанных на хирургической биопсии легких, была выявлена обычная интерстициальная пневмония как образец фиброза у пациентов с персистирующим интерстициальным заболеванием легких после COVID-19 (99 ) . Эти авторы также обнаружили другие модели повреждения легких, в том числе DAD, наложившийся на обычную интерстициальную пневмонию, дескваматичную интерстициальную пневмонию и острую организующуюся пневмонию. Наконец, следует отметить, что острое повреждение легких, особенно DAD, часто встречается у патологоанатома на перекрывающихся стадиях (т. е. острое с хроническим или острое и организующееся) (89 ) . На этом этапе также может возникнуть вторичная инфекция ( рис. 12 ) ( 93 ). На момент написания этой статьи сообщество легочных патологов активно изучает гистопатологические результаты долгосрочного лечения COVID-19, и в ближайшем будущем в этой области будет много сказано.

Заключение
Научное и медицинское сообщество многое узнало о диагностике и лечении COVID-19 за 2,5 года с тех пор, как были зарегистрированы первые случаи заболевания в Ухане, Китай. Хотя было опубликовано множество исследований по отдаленным последствиям COVID-19, существуют важные ограничения, в том числе небольшое количество случаев для некоторых описанных субъектов и предвзятость публикаций в сторону положительных исследований визуализации и заболеваний тяжелого спектра. Более того, исследования электронных медицинских карт на основе «больших данных» склонны к предвзятости отбора и информационной необъективности. Мета-анализ, обсуждаемый в этом обзоре, вносит некоторую ясность в данные, но в конечном итоге на него влияют включенные в него исследования переменных.
В настоящее время не существует единого мнения относительно методов визуализационного лечения пациентов с отдаленными последствиями пневмонии, вызванной COVID-19. Разумный подход может включать инспираторную КТ грудной клетки с тонкими срезами для характеристики подозреваемого паренхиматозного заболевания, а также экспираторную визуализацию, если это считается подходящим для оценки заболеваний мелких дыхательных путей. Визуализирующие исследования при подозрении на острую или хроническую тромбоэмболию легочной артерии можно проводить с помощью КТ-ангиографии легких или вентиляционно-перфузионного сканирования. Гиперполяризованная МРТ с 129 Xe уже давно показала себя перспективным инструментом для выявления отклонений у пациентов с хроническими симптомами и нормальной визуализацией, хотя она считается методом исследования и не широко доступна. Решения о визуализации должны основываться на признаках и симптомах пациента, тщательной клинической оценке и конкретных вопросах, на которые необходимо ответить.